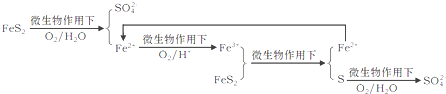
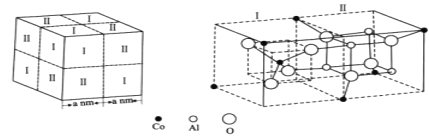
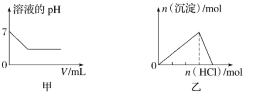
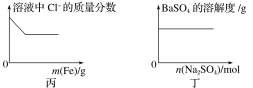
题目内容
【题目】25℃时,FeS、CuS的溶度积常数分别为6.3×10-18 mol2·L-2、1.3×10-36 mol2·L-2。下列说法中,错误的是( )
A.25℃时,FeS的溶解度大于CuS的溶解度
B.反应CuSO4+H2S=CuS↓+H2SO4不能发生
C.可用FeS作沉淀剂除去废水中的Cu2+
D.25℃时,饱和CuS溶液中,Cu2+的浓度为![]() ×10-18 mol·L-1
×10-18 mol·L-1
【答案】B
【解析】
A. FeS、CuS为同种类型的沉淀,且Ksp[FeS]远大于Ksp[CuS],所以FeS的溶解度大于CuS的溶解度,故A正确;
B. CuS是不溶于酸的黑色物质,所以能发生反应:CuSO4+H2S═CuS↓+H2SO4,这是弱酸制备强酸的特例,故B错误;
C. FeS的溶解度大于CuS的溶解度,根据溶解度大的沉淀可以转化成溶解度小的沉淀可知可用FeS作沉淀剂除去废水中的Cu2+,故C正确;
D.饱和CuS溶液中存在平衡![]() ,设铜离子的浓度为amol/L,则有Ksp[CuS]=c(Cu2+)·c(S2-)=amol/L·amol/L=1.3×10-36 mol2·L-2,解得c(Cu2+)=
,设铜离子的浓度为amol/L,则有Ksp[CuS]=c(Cu2+)·c(S2-)=amol/L·amol/L=1.3×10-36 mol2·L-2,解得c(Cu2+)=![]() ×10-18 mol·L-1,故D正确;
×10-18 mol·L-1,故D正确;
故答案为B。

 名校课堂系列答案
名校课堂系列答案【题目】实验室中有一未知浓度的稀盐酸,某同学在实验室中通过酸碱中和滴定实验测定盐酸的浓度。取20.00 mL待测盐酸放入锥形瓶中,并滴加23滴酚酞作指示剂,用标准的NaOH溶液进行滴定。重复上述滴定操作23次,记录数据如下:
实验编号 | NaOH溶液的浓度(molL-1) | 滴入NaOH溶液的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.10 | 22.10 | 20.00 |
2 | 0.10 | 22.00 | 20.00 |
3 | 0.10 | 21.90 | 20.00 |
(1)碱式滴定管用蒸馏水洗净后,接下来应该进行的操作是_____________________。
(2)该实验滴定达到终点的标志是__________________________。
(3)根据上述数据,可计算出该盐酸的浓度约为_________。(保留两位有效数字)
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_________。
A滴定终点读数时俯视读数
B滴定过程中,不小心滴到桌子上几滴
C碱式滴定管尖嘴部分有气泡,滴定后消失
D锥形瓶水洗后未干燥
【题目】设NA为阿伏加德罗常数的值。已知反应:
①CH4 (g) +2O2 (g) = CO2 (g) +2H2O(l) ΔH1 = a kJ mol-1
②CH4(g) + 2O2 (g) = CO2 (g) +2H2O(g) ΔH2 = bkJ mol-1
其他数据如下表所示,下列说法正确的是
化学键 | C=O | C—H | O—H | O=O |
键能/(kJ mol-1) | 798 | 413 | 463 | x |
A.ΔH1 < ΔH2
B.H2O(g) = H2O(1) ΔH=(a-b)kJ mol -1
C.当有4NA个O-H键生成时,反应放出的热量为a kJ
D.上文中x =![]()