题目内容
【题目】25℃时,改变某醋酸溶液的pH,溶液中c(CH3COO-)与c(CH3COOH)之和始终为0.1mol·L-1,溶液中H+、OH-、CH3COO-及CH3COOH浓度的常用对数值(lgc)与pH的关系如图所示。下列说法错误的是( )
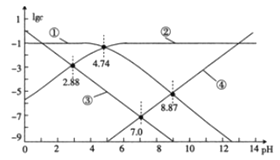
A.图中③表示lgc(H+)与pH的关系曲线
B.0.1mol·L-1CH3COOH溶液的pH约为2.88
C.lgK(CH3COOH)=4.74
D.向0.10mol·L-1醋酸钠溶液中加入0.1mol醋酸钠固体,水的电离程度变大
【答案】C
【解析】
当pH=0时,c(H+)=1mol/L,lgc(H+)=0,所以③表示lgc(H+)与pH的关系曲线。随着溶液pH的增大,c(CH3COOH)降低,所以①表示lgc(CH3COOH)与pH的关系曲线。当c(H+)= c(OH-)时,溶液呈中性,在常温下pH=7,所以④表示lgc(OH-)与pH的关系曲线。则②表示lgc(CH3COO-)与pH的关系曲线。
A.由以上分析可知,图中③表示lgc(H+)与pH的关系曲线,故A正确;
B.醋酸是弱酸,电离产生的H+和CH3COO-浓度可认为近似相等,从图像可以看出,当c(CH3COO-)= c(H+)时,溶液的pH约为2.88,所以0.1mol·L-1CH3COOH溶液的pH约为2.88,故B正确;
C.当c(CH3COO-) =c(CH3COOH)时,K= c(H+)。从图像可以看出,当溶液的pH=4.74时,c(CH3COO-) =c(CH3COOH),所以lgK(CH3COOH)= -4.74,故C错误;
D.向0.10mol·L-1醋酸钠溶液中加入0.1mol醋酸钠固体,c(CH3COO-)增大,溶液中的c(OH-)变大,溶液中的OH-全部来自水的电离,所以水的电离程度变大,故D正确;
故选C。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】下表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色;②比例模型为 |
B | ①由C、H两种元素组成;②球棍模型为 |
C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与D反应生成相对分子质量为100的酯 |
D | ①由C、H、O三种元素组成;②球棍模型为 |
回答下列问题:
(1)写出A与溴的四氯化碳溶液反应的化学方程式__________
(2)A与氢气发生加成反应后生成物质E,与E在分子组成和结构上相似的有机物有一大类(俗称"同系物"),它们均符合通式CnH2n+2。当n=______时,这类有机物开始出现同分异构体。
(3)B具有的性质是__________(填序号)。
①无色无味液体 ②有毒 ③不溶于水 ④密度比水大 ⑤与酸性KMnO4溶液和溴水反应褪色 ⑥任何条件下不与氢气反应
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式__________
(4)C与D反应能生成相对分子质量为100的酯,该反应的反应类型为____;其化学方程式为__________
【题目】纪录片《我在故宫修文物》表现了文物修复者穿越古今与百年之前的人进行对话的职业体验,让我们领略到历史与文化的传承。下列文物修复和保护的过程中涉及化学变化的是
A | B | C | D |
|
|
|
|
银器用除锈剂见新 | 变形的金属香炉复原 | 古画水洗除尘 | 木器表面擦拭烫蜡 |
A. AB. BC. CD. D