题目内容
【题目】已知断裂1molC﹣H键,要吸收热量414.4kJ;断裂1mol C﹣C键,要吸收热量347.4kJ;生成1mol C═C键,会放出热量615.3kJ;生成1mol H﹣H键,会放出热量435.3kJ,某有机物分解的反应可表示为: 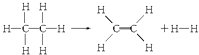
若在反应中消耗了1mol乙烷(反应物),则有关该反应的说法正确的是( )
A.该反应放出251.2 kJ的热量
B.该反应吸收251.2 kJ的热量
C.该反应放出125.6 kJ的热量
D.该反应吸收125.6 kJ的热量
【答案】D
【解析】解:1mol乙烷含有1molC﹣C键,6molC﹣H键,生成的乙烯含1molC=C键1molH﹣H键和4molC﹣H键,△H=347.4KJ+6×414.4KJ﹣4×414.4KJ﹣615.3KJ﹣435.3KJ=+125.6KJ,所以该反应吸收125.6KJ的热量, 故选:D.
△H=反应物键能和﹣生成物键能和,据此解答.

【题目】H2O2是常用的绿色氧化剂,H2S是还原剂,但H2S会对环境和人体健康带来极大危害。
I.H2S的除去,生物脱H2S的原理为:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4、4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O。
2Fe2(SO4)3+2H2O。
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是_____。
(2)由图甲和图乙判断他用硫杆菌的最佳条件为_______。在最佳条件下,该反应的加热方式为_________,若反应温度过高,反应速率下降,其原因是__________。

II.为研究硫酸饮的量对过氧化氢分解速率的影响,某同学设计了如下一系列的实验。将表中所给的溶液分别加入A、B、C、D四个反应瓶中,收集产生的气体,在关数据如下:
实验溶液 | A/mL | B/mL | C/mL | D/mL |
0.4mol/LFe2(SO4)3溶液 | 0 | 1.0 | 2.0 | V1 |
30%H2O2溶液 | V2 | 20.0 | 20.0 | 20.0 |
H2O | 18.0 | 17.0 | V3 | 15.0 |
(1)实验过程中需记录的数据是___________。
(2)上表中的V2=_______,V3=_________。