��Ŀ����
����Ŀ��H2O2�dz��õ���ɫ��������H2S�ǻ�ԭ������H2S��Ի��������彡����������Σ����
I.H2S�ij�ȥ��������H2S��ԭ��Ϊ:H2S+Fe2(SO4)3=S��+2FeSO4+H2SO4��4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O��
2Fe2(SO4)3+2H2O��
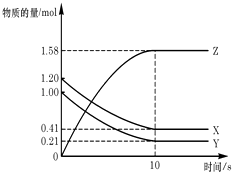
(1)��˾�����ʱ,FeSO4����������������ʱ��5��105�����þ���������_____��
(2)��ͼ��ͼ���ж�������˾����������Ϊ_______������������£��÷�Ӧ�ļ��ȷ�ʽΪ_________������Ӧ�¶ȹ��ߣ���Ӧ�����½�����ԭ����__________��

II.Ϊ�о������������Թ�������ֽ����ʵ�Ӱ�죬ijͬѧ���������һϵ�е�ʵ�顣��������������Һ�ֱ����A��B��C��D�ĸ���Ӧƿ�У��ռ����������壬�ڹ���������:
ʵ����Һ | A/mL | B/mL | C/mL | D/mL |
0.4mol/LFe2(SO4)3��Һ | 0 | 1.0 | 2.0 | V1 |
30%H2O2��Һ | V2 | 20.0 | 20.0 | 20.0 |
H2O | 18.0 | 17.0 | V3 | 15.0 |
(1)ʵ����������¼��������___________��
(2)�ϱ��е�V2=_______��V3=_________��
���𰸡� ���� 30�桢pH=2 ˮԡ���� �¶ȹ��ߣ���˾�ʧȥ���ԣ�ʧȥ�˴����ã���Ӧ�����½� ��ͬʱ�����ռ��������� �� �ռ���ͬ�������������Ҫ��ʱ�� 20.0 16.0
��������I.(1)��Ӧ4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3+2H2O����˾�����ʱ,FeSO4����������������ʱ��5��105������˸þ������������������ͷ�Ӧ�Ļ�ܣ�(2)��ͼ���з�����֪��ʹ����˾�������������������������������ʱ����Ҫ���¶Ⱥ���ҺpH�ֱ�Ϊ��30�桢pH=2.0������������£��÷�Ӧ�ļ��ȷ�ʽΪˮԡ���ȣ���Ӧ�¶ȹ��ߣ���Ӧ�����½�����Ϊ����ʹ�����ʷ������ԣ�����ʧȥ�������ԣ�
2Fe2(SO4)3+2H2O����˾�����ʱ,FeSO4����������������ʱ��5��105������˸þ������������������ͷ�Ӧ�Ļ�ܣ�(2)��ͼ���з�����֪��ʹ����˾�������������������������������ʱ����Ҫ���¶Ⱥ���ҺpH�ֱ�Ϊ��30�桢pH=2.0������������£��÷�Ӧ�ļ��ȷ�ʽΪˮԡ���ȣ���Ӧ�¶ȹ��ߣ���Ӧ�����½�����Ϊ����ʹ�����ʷ������ԣ�����ʧȥ�������ԣ�
II.(1)�о������������Թ�������ֽ����ʵ�Ӱ�죬��Ҫ��¼�ռ���ͬ������������ʱ�䣨����ͬʱ�����ռ�������������(2)�о������������Թ�������ֽ����ʵ�Ӱ�죬��������Ҫ��ͬ��������ÿ��ʵ����������ͬ����B�еó���Һ�������Ϊ38.0mL������V2=20.0mL��V3=16.0mL��

����Ŀ�������飨C8H10�����������ϵ��屽��ϩ��C8H8�����䷴Ӧԭ����C8H10��g��C8H8��g��+H2��g����H��0 ��ij�¶��£���0.40mol�����飬����2L����ܱ������з�����Ӧ���ⶨ��ͬʱ������������ʵ������õ��������±���
ʱ��/min | 0 | 10 | 20 | 30 | 40 |
n��C8H10��/mol | 0.40 | 0.30 | 0.26 | n2[��Դ��] | n3 |
n��C8H8��/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
��1������Ӧ���е�20minʱ���ö�ʱ����H2��ƽ����Ӧ������ ��
��2�����¶��£��÷�Ӧ�Ļ�ѧƽ�ⳣ���� ��
��ѧ�� | C��H | C��C | C=C | H��H |
����/kJmol1 | 412.5 | 348 | 612 | 436 |
��3����֪�� ����������Ӧ�ġ�H=kJmol��1 �� �����������������䣬��0.40mol H2��g����0.40mol C8H8��g���ϳ�C8H10��g��������30kJ�����ų�ʱ���÷�Ӧ��H2��ת������ �� ��ʱ���÷�Ӧ�Ƿ�ﵽ��ƽ��״̬������ǡ�����
��ҵ���Ը���ˮ������Ϊ��Ӧ��ϵ��ϡ�ͼ��������뷴Ӧ����C8H10��g����ƽ��ת������ˮ��������������ϵ���¶ȡ�ѹǿ�Ĺ�ϵ��ͼ��ͼ����ʾ��
��4����ͼ���֪��T1T2������ڡ�����С�ڡ����ڡ�����
��5����ͼ���֪����������������ʱ��ˮ����������Խ��C8H10��ƽ��ת���ʽ����Խ����ԽС�����䡱����ԭ���� ��