题目内容
【题目】2016年朝鲜进行氢弹实验.引起国际社会的极大关注。下列关于31H的说法正确的是( )
A. 质量数是1B. 质子数是2C. 中子数是2D. 电子数是3
【答案】C
【解析】
在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,据此分析解答。
A、该核素的质量数是3,A错误;
B、质子数是1,B错误;
C、质子数+中子数=质量数,因此中子数=3-1=2,C正确;
D、核外电子数=质子数=1,D错误;
答案选C。

 全能测控一本好卷系列答案
全能测控一本好卷系列答案【题目】现代煤化工产生的H2S是一种重要的工业资源。请回答:
(1)用过量的NaOH吸收H2S,请写出该反应的离子方程式:____________。硫化钠又称臭碱,其溶液盛装在带橡胶塞的试剂瓶中,请用离子方程式解释其溶液呈碱性的原因为:_______。己知:25℃时,H2S的Ka1=1×10-7,Ka2=1×10-12,计算此温度时1mol/LNa2S溶液的pH=____。(结果取整数)
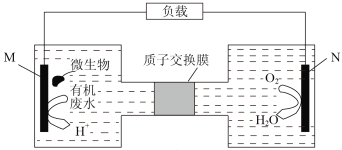
(2)用电解法处理Na2S溶液是处理硫化氢废气的一个重要环节。实验装置如图:
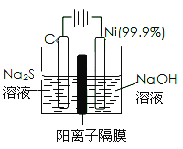
已知阳极的反应为xS2--2(x-1)e-=Sx2-,则阴极的电极反应式是_________,当反应转移nmole-时,产生标准状况下的气休体积为__________________。
(3)H2S是煤化工原料气脱硫过程的重要中间体。反应原理为:
①COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7kJ/mol
H2S(g)+CO(g) △H=+7kJ/mol
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-42kJ/mol
CO2(g)+H2(g) △H=-42kJ/mol
已知断裂1mol气态分子中的化学键所需能量如下表所示。
分子 | COS | H2 | H2O | CO | H2S | CO2 |
能量/kJ/mol | 1323 | 436 | 926 | X | 678 | 1606 |
计算表中x=____________。
(4)向2L容积不变的密闭容器中充入2molCOS(g),2molH2(g)和2molH2O(g),进行(3)中所述两个反应,其他条件不变,随着温度升高,CO的平衡体积分数增大,解释其原因为_____________。平衡体系中COS的物质的量为1.6mol时,CO的体积分数为5%,则H2O的平衡转化率为______,反应②的平衡常数为______(保留两位有效数字)。