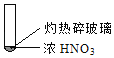题目内容
【题目】Ⅰ.用化学用语回答下列问题:
(1)写出二氧化碳分子的电子式:___________;
(2)写出氮气分子的结构式___________。
Ⅱ.下列物质:① N2 ② CO2 ③ NH3 ④ Na2O ⑤Na2O2 ⑥ NaOH ⑦ CaBr2 ⑧ H2O2 ⑨ NH4Cl ⑩ HBr。
(1)含有极性键和非极性键的是_______;
(2)含有非极性键的离子化合物是_____。(填序号,下同)
Ⅲ.下列变化中:① 干冰气化; ② 硝酸钾熔化; ③ KHSO4熔融; ④ 硫酸溶于水;
⑤ 蔗糖溶于水;⑥ HI分解; ⑦ 碘升华; ⑧ 溴蒸气被木炭吸附。
(1)未破坏化学键的是_____;
(2)仅离子键被破坏的是____;
(3)仅共价键被破坏的是____。
Ⅳ.下列物质:① 1H、2H、3H ; ② H2O、D2O、T2O; ③ O2、O3; ④ 14N、14C
(1)互为同位素的是:______;
(2)互为同素异形体的是:______;
(3)氢的三种原子1H、2H、3H 与氯的两种原子35Cl、37Cl相互结合为氯化氢,可得分子中相对分子质量不同的有________种。
【答案】 ![]() N≡N ⑧ ⑤ ① ⑤ ⑦ ⑧ ② ③ ④ ⑥ ① ③ 5
N≡N ⑧ ⑤ ① ⑤ ⑦ ⑧ ② ③ ④ ⑥ ① ③ 5
【解析】试题分析:(1)二氧化碳分子的结构式是O=C=O;
(2)氮气分子中存在三键。
Ⅱ. ① N2含有非极性键; ② CO2含有极性键; ③ NH3 含有极性键;④ Na2O 含有离子键;⑤Na2O2 含有离子键、非极性键;⑥ NaOH 含有离子键、极性键;⑦ CaBr2 含有离子键;⑧ H2O2含有极性键、非极性键; ⑨ NH4Cl含有离子键、极性键;⑩ HBr含有极性键。
Ⅲ.① 干冰气化仅破坏分子间作用力; ② 硝酸钾熔化破坏离子键; ③ KHSO4熔融破坏离子键; ④ 硫酸溶于水破坏共价键;
⑤ 蔗糖溶于水破坏分子间作用力;⑥ HI分解破坏共价键; ⑦ 碘升华破坏分子间作用力; ⑧ 溴蒸气被木炭吸附未破坏化学键。
Ⅳ. (1)同位素质子数相同、中子数不同的原子;
(2)同素异形体是同种元素组成的不同单质;
(3)1H、2H、3H分别与35Cl、37Cl结合成1H35Cl、2H35Cl、3H35Cl、1H37Cl、2H37Cl、3H37Cl六种形式
解析:根据以上分析,(1)二氧化碳分子的电子式为![]() ;
;
(2)氮气分子中存在三键,结构式为N≡N。
Ⅱ.(1)含有极性键和非极性键的是H2O2;
(2)含有非极性键的离子化合物是Na2O2;
Ⅲ.(1)未破坏化学键的是① 干冰气化、⑤ 蔗糖溶于水、⑦ 碘升华、 ⑧ 溴蒸气被木炭吸附;
(2)仅离子键被破坏的是② 硝酸钾熔、③ KHSO4熔融;
(3)仅共价键被破坏的是④ 硫酸溶于水、⑥ HI分解。
Ⅳ.(1)属于同位素的是① 1H、2H、3H;
(2)互为同素异形体是③ O2、O3;
(3)1H、2H、3H分别与35Cl、37Cl结合成1H35Cl、2H35Cl、3H35Cl、1H37Cl、2H37Cl、3H37Cl六种形式,3H35Cl和1H37Cl相对分子质量都是38,所以相对分子质量却只有5种。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
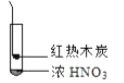
小学生10分钟应用题系列答案【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
【题目】人口资源环境委员会副主任、中国科学院院士秦大河表示,当前情况下散烧煤和没有清洁的煤是造成中国城市雾霾或者东部雾霾的主要原因。煤的气化是解决雾霾,清洁地利用煤炭的重要途径之一。
⑴已知:H2O(g)=H2O(I) △H=-44kJ/mol
物质 | H2(g) | C(s) | CO(g) |
燃烧热kJ/mol | -285.8 | -393.5 | -283.0 |
①请写出煤的气化反应生成合成气(CO和H2)的热化学方程式___________。
②在恒温、恒容的反应器中,能表明上述反应达到平衡状态的是_______。
a.混合气体平均相对分子质量不再改变
b.气体压强不再改变
c.各气体浓度相等
d.反应体系中温度保持不变
e.断裂氢氧键速率是断裂氢氢键速率的2倍
f.混合气体密度不变
g.单位时间内,消耗水的质量与生成氢气的质量比为9:1
⑵在催化剂作用下合成气合成甲烷过程中会发生如下反应:
I CO(g)+3H2(g) = CH4(g)+H2O(g) △H1= -206 kJ/mol
II CO(g)+H2O(g) = CO2(g)+H2(g) △H2= -41 kJ/mol
Ⅲ 2CO(g)+2H2(g)= CH4(g)+CO2(g) △H 3= -247.4 kJ/mol
①图1是太原理工大学煤化工研究所利用热力学数据分析得到温度对反应ⅠInK(化学平衡常数K的自然对数)的曲线图,请分析出现这样趋势的原因是____________。
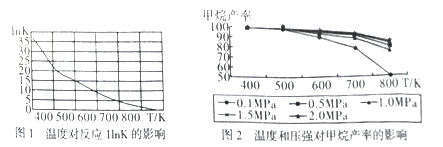
②提高甲烷反应选择性的关键因素是_______,根据相关知识和图2分析合成甲烷适宜的反应条件是在550~630K,1MPa的原因是__________________。
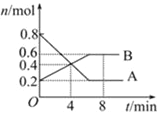
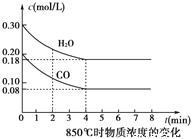
③850℃时在体积为5L反应器中发生反应Ⅱ,CO和H2O(g)浓度变化如图所示,请列式计算此条件下的平衡常数_____________ 。
(3)CH4燃料电池利用率很高,装置中添加1L2mol/L的KOH溶液为电解质,持续缓慢通入标准状况下甲烷22.4L~33.6 L时负极电极反应为___________。