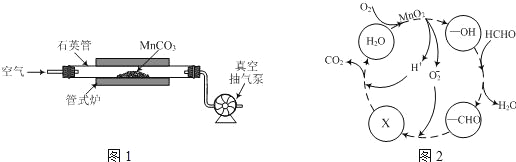
题目内容
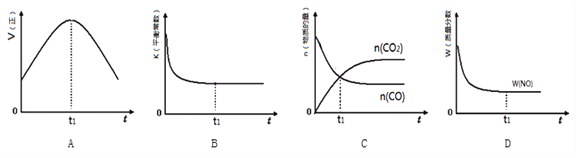
【题目】某温度时,在0.5L密闭容器中某一反应的A,B气体物质随时间变化的曲线如图所示,由图中数据分析求得:

(1)该反应的化学方程式为 .
(2)反应开始至4min时,B的平均反应速率为 .
(3)平衡时A的转化率为 .第4min时,正、逆反应速率的大小关系为:v(正) v(逆)(填“>”、“<”或“=”,下同),第8min时,v(正) v(逆).
【答案】(1)3A![]() 2B; (2)0.1mol/(L·min); (3)75%;>;=.
2B; (2)0.1mol/(L·min); (3)75%;>;=.
【解析】
试题分析:(1)根据图示可知A是反应物,B是生成物,在相同时间内A、B改变的物质的量的比是0.6:0.4=3:2,由于物质反应的物质的量的比等于方程式的化学计量数的比,而且最终各种物质都存在,不再发生变化,所以该反应是可逆反应,化学方程式是3A![]() 2B;(2)根据图像可知:从反应开始至4min时,B的物质的量改变了0.2mol,由于物质反应的速率是单位时间内的浓度改变值,所以用B表示的平均反应速率为V(B)=0.2mol÷0.5L÷4min=0.1mol/(L·min);(3)平衡时A的转化率为(0.6mol÷ 0.8mol)× 100%=75%;根据图像可知第4min时,反应物的浓度还在减小,生成物的浓度还在增加,说明反应正向进行,正、逆反应速率的大小关系为:v(正)>v(逆),当到第8min时,各种物质的浓度不变,反应达到平衡,此时v(正)=v(逆)。
2B;(2)根据图像可知:从反应开始至4min时,B的物质的量改变了0.2mol,由于物质反应的速率是单位时间内的浓度改变值,所以用B表示的平均反应速率为V(B)=0.2mol÷0.5L÷4min=0.1mol/(L·min);(3)平衡时A的转化率为(0.6mol÷ 0.8mol)× 100%=75%;根据图像可知第4min时,反应物的浓度还在减小,生成物的浓度还在增加,说明反应正向进行,正、逆反应速率的大小关系为:v(正)>v(逆),当到第8min时,各种物质的浓度不变,反应达到平衡,此时v(正)=v(逆)。

【题目】利用下图所示装置进行实验,将仪器a中的溶液滴入b中,根据c中所盛溶液,预测其中现象正确的是

选项 | a | b | c | c试管中现象 |
A | 浓盐酸 | KMnO4 | FeCl2溶液 | 溶液变棕黄色 |
B | 稀硫酸 | Na2S2O3 | 溴水 | 产生浅黄色沉淀 |
C | 硼酸 | Na2CO3 | Na2SiO3溶液 | 析出白色沉淀 |
D | 浓硝酸 | 铁片 | KI-淀粉溶液 | 溶液变蓝色 |