��Ŀ����
����Ŀ���˿���Դ����ίԱ�ḱ���Ρ��й���ѧԺԺʿ�ش�ӱ�ʾ����ǰ�����ɢ��ú��û������ú������й������������߶�����������Ҫԭ��ú�������ǽ����������������ú̿����Ҫ;��֮һ��
����֪:H2O(g)=H2O(I) ��H=-44kJ/mol
���� | H2(g) | C(s) | CO(g) |
ȼ����kJ/mol | -285.8 | -393.5 | -283.0 |
����д��ú��������Ӧ���ɺϳ���(CO��H2)���Ȼ�ѧ����ʽ___________��
���ں��¡����ݵķ�Ӧ���У��ܱ���������Ӧ�ﵽƽ��״̬����_______��
a.�������ƽ����Է����������ٸı�
b.����ѹǿ���ٸı�
c.������Ũ�����
d.��Ӧ��ϵ���¶ȱ��ֲ���
e.���������������Ƕ�����������ʵ�2��
f.��������ܶȲ���
g.��λʱ���ڣ�����ˮ������������������������Ϊ9��1
���ڴ��������ºϳ����ϳɼ�������лᷢ�����·�Ӧ��
I CO(g)+3H2(g) = CH4(g)+H2O(g) ��H1= -206 kJ/mol
II CO(g)+H2O(g) = CO2(g)+H2(g) ��H2= -41 kJ/mol
�� 2CO(g)+2H2(g)= CH4(g)+CO2(g) ��H 3= -247.4 kJ/mol
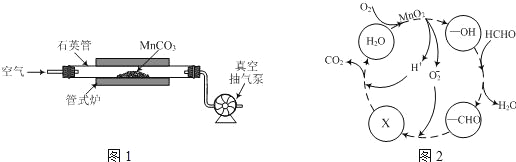
��ͼ1��̫ԭ������ѧú�����о�����������ѧ���ݷ����õ��¶ȶԷ�Ӧ��InK(��ѧƽ�ⳣ��K����Ȼ����)������ͼ,����������������Ƶ�ԭ����____________��

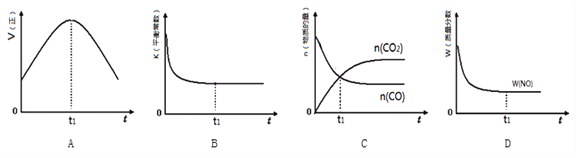
������鷴Ӧѡ���ԵĹؼ�������_______���������֪ʶ��ͼ2�����ϳɼ������˵ķ�Ӧ��������550��630K��1MPa��ԭ����__________________��
��850��ʱ�����Ϊ5L��Ӧ���з�����Ӧ��CO��H2O(g)Ũ�ȱ仯��ͼ��ʾ������ʽ����������µ�ƽ�ⳣ��_____________ ��

(3)CH4ȼ�ϵ�������ʺܸߣ�װ��������1L2mol/L��KOH��ҺΪ����ʣ���������ͨ���״���¼���22.4L��33.6 Lʱ�����缫��ӦΪ___________��
���𰸡� �Ţ� C(s)+H2O(g)=CO(g)+H2(g) ��H=+131.31kJ/mol �� abef
�Ƣ���������������ʱ,�¶����߷�ӦI�����ȵ��淴Ӧ�����ƶ�ʹInK��С������ �������·�Ӧ���ʽϿ���Ҽ�����ʽϸ� ��K= ![]() =
=![]() =1
=1
��CH4-8e-+9CO32-+3H2O=10HCO3-
���������Ţ���֪����H2O(g)=H2O(I) ��H1= -44kJ/mol ��H2(g)+![]() O2(g)=H2O(l) ��H2= -285.8kJ/mol ��C(s)+O2(g)=CO2 ��H3= -393.5 kJ/mol ��CO(g)
O2(g)=H2O(l) ��H2= -285.8kJ/mol ��C(s)+O2(g)=CO2 ��H3= -393.5 kJ/mol ��CO(g)![]() O2(g)=CO2 ��H4= -283.0 kJ/mol�����ݸ�˹���ɢ�+��-��-�ܿɵ�C(s)+H2O(g)=CO(g)+H2(g) ����H=��+��-��-��=( -393.5 kJ/mol)+(-44kJ/mol)-(-285.8kJ/mol)-(-283.0 kJ/mol)=+131.31kJ/mol����ú��������Ӧ���ɺϳ���(CO��H2)���Ȼ�ѧ����ʽΪC(s)+H2O(g)
O2(g)=CO2 ��H4= -283.0 kJ/mol�����ݸ�˹���ɢ�+��-��-�ܿɵ�C(s)+H2O(g)=CO(g)+H2(g) ����H=��+��-��-��=( -393.5 kJ/mol)+(-44kJ/mol)-(-285.8kJ/mol)-(-283.0 kJ/mol)=+131.31kJ/mol����ú��������Ӧ���ɺϳ���(CO��H2)���Ȼ�ѧ����ʽΪC(s)+H2O(g)![]() CO(g)+H2(g) ��H=+131.31kJ/mol��
CO(g)+H2(g) ��H=+131.31kJ/mol��
����֪C(s)+H2O(g)![]() CO(g)+H2(g) ��Ӧ������һ���ǹ��壬�����﷽�����������ķ���a.����������������������ʵ����Dz�ȷ��ֵ�����������ƽ����Է����������ٸı�ʱ��ƽ��״̬����a��ȷ��b.��Ӧ�������������ʵ����Dz�ȷ����ֵ��������ѹǿ���ٸı�ʱ��˵�����������ʵ������ٸı䣬��ƽ��״̬����b��ȷ��c.������Ũ�����ʱ��һ����ƽ��״̬����c����d.�����������¶ȱ��ֲ��䣬��ϵ��һ���ﵽƽ�⣬��d����e.���������������Ƕ�����������ʵ�2����˵���ﵽƽ��״̬����e��ȷ��f.��������ܶȲ��䣬˵�������������������ʱ��ı仯���仯����ƽ��״̬����f��ȷ��g.��λʱ���ڣ�����ˮ������������������������Ϊ9��1����Ϊ����Ӧ���ʣ����ж���ƽ��״̬����g����Ϊabef��
CO(g)+H2(g) ��Ӧ������һ���ǹ��壬�����﷽�����������ķ���a.����������������������ʵ����Dz�ȷ��ֵ�����������ƽ����Է����������ٸı�ʱ��ƽ��״̬����a��ȷ��b.��Ӧ�������������ʵ����Dz�ȷ����ֵ��������ѹǿ���ٸı�ʱ��˵�����������ʵ������ٸı䣬��ƽ��״̬����b��ȷ��c.������Ũ�����ʱ��һ����ƽ��״̬����c����d.�����������¶ȱ��ֲ��䣬��ϵ��һ���ﵽƽ�⣬��d����e.���������������Ƕ�����������ʵ�2����˵���ﵽƽ��״̬����e��ȷ��f.��������ܶȲ��䣬˵�������������������ʱ��ı仯���仯����ƽ��״̬����f��ȷ��g.��λʱ���ڣ�����ˮ������������������������Ϊ9��1����Ϊ����Ӧ���ʣ����ж���ƽ��״̬����g����Ϊabef��
�Ƣ�CO(g)+3H2(g) = CH4(g)+H2O(g) ��H1= -206 kJ/mol�˷�Ӧ�������Ƿ��ȷ�Ӧ���������������������£������¶�ƽ�������ƶ���ƽ�ⳣ�����٣�InKҲ��С��
�ڴ���ֻ�ı䷴Ӧ���ʣ���Ӱ��ƽ����ƶ���������鷴Ӧѡ���ԵĹؼ����أ��������֪ʶ��ͼ2��������550��630K��1Mpa�������·�Ӧ���ʽϿ���Ҽ�����ʽϸ��Ǻϳɼ������˵ķ�Ӧ������
�� CO(g)+H2O(g) ![]() CO2(g)+H2(g)
CO2(g)+H2(g)
��ʼŨ�ȣ�mol/L�� 0.20 0.30 0 0
�仯Ũ�ȣ�mol/L�� 0.12 0.12 0.12 0.12
ƽ��Ũ�ȣ�mol/L�� 0.08 0.18 0.12 0.12
50��ʱ�����µ�ƽ�ⳣ��K= ![]() =
=![]() =1��
=1��
(3)n��KOH��=2mol/L��1L=2mol����װ����ȼ�ϵ�أ������ϼ���ʧ���ӷ���������Ӧ�������������õ��ӷ�����ԭ��Ӧ��22.4L��V��33.6Lʱ������ԭ���غ��1mol��n��CO2����1.5mol����Ӧ����̼����أ�������ӦʽΪCH4-8e-+9CO32-+3H2O=10HCO3-��

����Ŀ������/H2O2��Һ����������������������
(1)��֪T��ʱ��2SO2(g)+O2(g) ![]() 2SO3(g) ��H1
2SO3(g) ��H1
2H2O2(I)=2H2O(I)+O2(g) ��H2
SO3(g)+H2O(I))=H2SO4(I) ��H3
��SO2(g)+H2O2(I))=H2SO4(I) ��H4=__________ (�ú���H1����H2����H3�Ĵ���ʽ��ʾ)
(2)����[CO(NH2)2]��Һ��NOx��SO2��һ�����ѳ��ʡ���SO2��NOx (N��Լռ90%)ͨ���������������Ϊ7%������Ũ��Ϊ5%�ķ�Ӧ���н��з�Ӧ��
��������SO2����ת��Ϊһ�����Σ��仯ѧʽΪ______________��NO��NO2�����ʵ���֮��1:1��CO(NH2)2��Ӧ����������Ļ�ѧ����ʽΪ_________________________��
�ڰ��������(H2NCOONH4)�����ص�ˮ������һ�����İ�����������ں����ܱ������У�������Ӧ��NH2COONH4(s)![]() 2NH3(g)��CO2(g) ��H��ʵ���ò�ͬ�¶���ƽ��ʱ�������Ũ�����±���
2NH3(g)��CO2(g) ��H��ʵ���ò�ͬ�¶���ƽ��ʱ�������Ũ�����±���
�¶�/K | 338 | 343 | 348 | 353 |
ƽ��ʱ�������Ũ��/mol L-1 | 0.36 | 0.48 | 0.60 | 0.72 |
�÷�Ӧ�ġ�H__________(�>����<��)0��348Kʱ���÷�Ӧ��ƽ�ⳣ��K__________________��
(3)�����������䣬��������Һ������H2O2��Һ����ò�ͬ pH�µ���������ѳ�����ʱ��Ĺ�ϵ��ͼ
��ʾ��

��NO��H2O2������Ӧ����������ʱ���������뻹ԭ�������ʵ���֮��Ϊ____________��
������ʱ�����pHΪ_________���ڼ��Խ�ǿʱ��NOx�ѳ��ʽ��ͣ���ԭ����_____________________
(��дһ��)��