题目内容
 某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
(1)写出试管B中的实验现象______.
(2)写出A中反应的化学方程式______
(3)继续向A试管中加入H2O2,发现铜片溶解,反应的离子方程式为:______.
若仍不补充浓硫酸,只要求使铜片溶解,也可以加入(填写两种属于不同类别物质的化学式)______、______.
(4)B试管口的棉花应沾有的试剂是______.
(5)小组成员向反应后的溶液中加入足量的氧化铜,使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却结晶制得硫酸铜晶体(CuSO4?xH2O).小组成员采用加热法测定该晶体里结晶水x的值.
①在他们的实验操作中,至少称量______次;
②下面是其中一次实验的数据:
| 坩埚质量 | 坩埚与晶体的总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.9g |
A.硫酸铜晶体中含有不挥发的杂质 B.实验前晶体表面有湿存水
C.加热时有晶体飞溅出去 D.加热失水后露置在空气中冷却.
解:(1)二氧化硫具有漂白性,能使品红褪色,故答案为:品红溶液褪色;
(2)铜与浓硫酸在加热条件下反应生成硫酸铜和二氧化硫气体,反应的化学方程式为Cu+2H2SO4 CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4
CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4 CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(3)在酸性条件下,过氧化氢具有强氧化性,能氧化Cu而生成铜离子和水,反应的方程式为Cu+H2O2+2H+=Cu2++2H2O,根据铜能与铁离子、硝酸根离子反应,也可选用Fe2O3或NaNO3,
故答案为:Cu+H2O2+2H+=Cu2++2H2O;Fe2O3;NaNO3;
(4)二氧化硫为有毒气体,不能排放到空气中,根据二氧化硫为酸性气体,应用NaOH溶液吸收,故答案为:NaOH(溶液);
(5)①实验中为准确测定结晶水的值,应分别测定坩埚的质量、坩埚与晶体的总质量,以此测定晶体的质量,然后称量加热后坩埚与固体总质量,之后再加热一次以判断晶体是否完全分解,总共称量4次,故答案为:4;
②该实验晶体的质量为22.7g-11.7g=11g,硫酸铜的质量为18.9g-11.7g=7.2g,水的质量为22.7g-18.9g=3.8g,则n(CuSO4)= =0.045mol,n(H2O)=
=0.045mol,n(H2O)=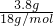 =0.21mol,所以
=0.21mol,所以
x= =4.7,小于5,硫酸铜晶体中含有不挥发的杂质,加热失水后露置在空气中冷却等都会造成硫酸铜的质量偏大,水的质量偏小,而实验前晶体表面有湿存水或加热时有晶体飞溅出去,会造成质量差偏大,结果偏大.
=4.7,小于5,硫酸铜晶体中含有不挥发的杂质,加热失水后露置在空气中冷却等都会造成硫酸铜的质量偏大,水的质量偏小,而实验前晶体表面有湿存水或加热时有晶体飞溅出去,会造成质量差偏大,结果偏大.
故答案为:偏小;AD.
分析:(1)二氧化硫具有漂白性,能使品红褪色;
(2)铜与浓硫酸在加热条件下反应生成硫酸铜和二氧化硫气体;
(3)在酸性条件下,铁离子、硝酸根离子以及过氧化氢具有强氧化性,能氧化Cu而生成铜离子;
(4)二氧化硫为有毒气体,不能排放到空气中,根据二氧化硫为酸性气体,应用NaOH溶液吸收;
(5)①实验中为准确测定结晶水的值,应分别测定坩埚的质量、坩埚与晶体的总质量,以此测定晶体的质量,然后称量加热后坩埚与固体总质量,之后再加热一次以判断晶体是否完全分解,总共称量4次;
②根据表中数据计算硫酸铜和结晶水的物质的量,进而计算X值,并分析可能的原因.
点评:本题考查铜与浓硫酸的反应,题目难度不大,本题注意(3)为易错点,从铜的还原性和过氧化氢、铁离子以及硝酸根离子的氧化性的角度思考.
(2)铜与浓硫酸在加热条件下反应生成硫酸铜和二氧化硫气体,反应的化学方程式为Cu+2H2SO4
 CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4
CuSO4+SO2↑+2H2O,故答案为:Cu+2H2SO4 CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;(3)在酸性条件下,过氧化氢具有强氧化性,能氧化Cu而生成铜离子和水,反应的方程式为Cu+H2O2+2H+=Cu2++2H2O,根据铜能与铁离子、硝酸根离子反应,也可选用Fe2O3或NaNO3,
故答案为:Cu+H2O2+2H+=Cu2++2H2O;Fe2O3;NaNO3;
(4)二氧化硫为有毒气体,不能排放到空气中,根据二氧化硫为酸性气体,应用NaOH溶液吸收,故答案为:NaOH(溶液);
(5)①实验中为准确测定结晶水的值,应分别测定坩埚的质量、坩埚与晶体的总质量,以此测定晶体的质量,然后称量加热后坩埚与固体总质量,之后再加热一次以判断晶体是否完全分解,总共称量4次,故答案为:4;
②该实验晶体的质量为22.7g-11.7g=11g,硫酸铜的质量为18.9g-11.7g=7.2g,水的质量为22.7g-18.9g=3.8g,则n(CuSO4)=
 =0.045mol,n(H2O)=
=0.045mol,n(H2O)=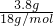 =0.21mol,所以
=0.21mol,所以x=
 =4.7,小于5,硫酸铜晶体中含有不挥发的杂质,加热失水后露置在空气中冷却等都会造成硫酸铜的质量偏大,水的质量偏小,而实验前晶体表面有湿存水或加热时有晶体飞溅出去,会造成质量差偏大,结果偏大.
=4.7,小于5,硫酸铜晶体中含有不挥发的杂质,加热失水后露置在空气中冷却等都会造成硫酸铜的质量偏大,水的质量偏小,而实验前晶体表面有湿存水或加热时有晶体飞溅出去,会造成质量差偏大,结果偏大.故答案为:偏小;AD.
分析:(1)二氧化硫具有漂白性,能使品红褪色;
(2)铜与浓硫酸在加热条件下反应生成硫酸铜和二氧化硫气体;
(3)在酸性条件下,铁离子、硝酸根离子以及过氧化氢具有强氧化性,能氧化Cu而生成铜离子;
(4)二氧化硫为有毒气体,不能排放到空气中,根据二氧化硫为酸性气体,应用NaOH溶液吸收;
(5)①实验中为准确测定结晶水的值,应分别测定坩埚的质量、坩埚与晶体的总质量,以此测定晶体的质量,然后称量加热后坩埚与固体总质量,之后再加热一次以判断晶体是否完全分解,总共称量4次;
②根据表中数据计算硫酸铜和结晶水的物质的量,进而计算X值,并分析可能的原因.
点评:本题考查铜与浓硫酸的反应,题目难度不大,本题注意(3)为易错点,从铜的还原性和过氧化氢、铁离子以及硝酸根离子的氧化性的角度思考.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究。
(1)写出试管B中的实验现象 。
(2)写出A中反应的化学方程式: 。
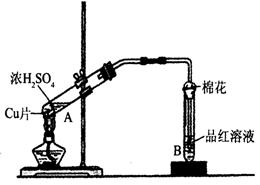 (3)充分反应后,若A试管中有铜片剩余,继续向A中加入
(3)充分反应后,若A试管中有铜片剩余,继续向A中加入
NaNO3,发现铜片溶解,反应的离子方程式
为 。
(4)充分反应后,若A试管中无铜片剩余,
但出现白色混浊,该白色固体是 ,
初步确认该白色固体是什么物质的实验操作方法
是 。
(5)B试管口的棉花应沾有的试剂是 。
(6)小组成员向(4)反应后的溶液中加入足量的氧化铜。使剩余的硫酸全部转化为硫酸铜,过滤后,将滤液加热浓缩,冷却后结晶制得硫酸铜晶体(CuSO4·xH2O)。小组成员采用加热法测定该晶体里结晶水x的值
①在他们的实验操作中,至少称量四次,最后两次称量的目的是
②下面是其中一次实验的数据:
| 坩埚质量 | 坩埚与晶体的总质量 | 加热后坩埚与固体总质量 |
| 11.0g | 37.8g | 27.0g |
根据上表数据计算判断x的实测值比理论值(x=5) (填“偏大”、“偏小”)。

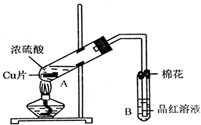 某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.