题目内容
为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是( )
| | 电池 | 电解池 |
| A | H+移向Pb电极 | H+移向Pb电极 |
| B | 每消耗3 mol Pb | 生成2 mol Al2O3 |
| C | 正极:PbO2+4H++ 2e-=Pb2++2H2O | 阳极:2Al+3H2O- 6e-=Al2O3+6H+ |
| D | 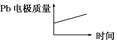 |  |
D
解析

 名校课堂系列答案
名校课堂系列答案中国人民银行定于2011年4月15日发行中国京剧脸谱彩色金银纪念币,其中银纪念币材料为铜芯镀银,依据你所掌握的电镀原理,你认为银纪念币制作时,铜芯应做
| A.阴极 | B.阳极 | C.正极 | D.负极 |
全钒氧化还原液流电池是一种新型电能储存和高效转化装置,该电池是将具有不同价态的钒离子溶液分别作为正极和负极的活性物质,分别储存在各自的酸性电解液储罐中。其结构原理如下图所示,该电池放电时,右槽中的电极反应为:V2+ - e- = V3+,下列说法正确的是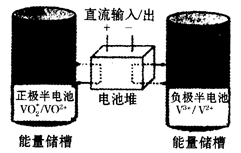
| A.放电时,右槽发生还原反应 |
| B.充电时,阴极电解液pH升高 |
| C.充电时,每转移lmol电子,n(H+)的变化量为l mol |
| D.放电时,左槽的电极反应式:VO2++ 2H+ + e-= VO2++ H2O |
如图所示,杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁丝反应及两边浮力的变化)( )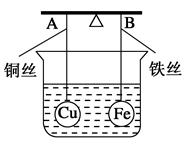
| A.杠杆为导体和绝缘体时,均为A端高B端低 |
| B.杠杆为导体和绝缘体时,均为A端低B端高 |
| C.当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低 |
| D.当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高 |
用a、b两个质量相等的Pt电极电解AlCl3和CuSO4的混合溶液[n(AlCl3)∶n(CuSO4)=1∶9]。t1时刻a电极得到混合气体,其中Cl2在标准状况下为224 mL(忽略气体的溶解);t2时刻Cu全部在电极上析出。下列判断正确的是( )
| A.a电极与电源的负极相连 |
| B.t2时,两电极的质量相差3.84 g |
| C.电解过程中,溶液的pH不断增大 |
| D.t2时,b的电极反应是4OH--4e-=2H2O+O2↑ |
下列叙述错误的是( )
| A.生铁中含有碳,抗腐蚀能力比纯铁弱 |
| B.用锡焊接的铁质器件,焊接处易生锈 |
| C.在铁制品上镀铜时,镀件为阳极,铜盐为电镀液 |
| D.铁管上镶嵌锌块,铁管不易被腐蚀 |
如图是铅蓄电池充、放电时的工作示意图,已知放电时电池反应为:PbO2+Pb+4H++2S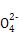 =2PbSO4+2H2O。下列有关说法正确的是( )
=2PbSO4+2H2O。下列有关说法正确的是( )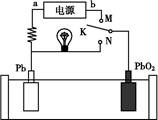
| A.K与N相接时,能量由电能转化为化学能 |
| B.K与N相接时,H+向负极区迁移 |
| C.K与M相接时,阳极附近的pH逐渐增大 |
| D.K与M连接时,所用电源的a极为负极 |
某铅酸蓄电池的工作原理如图所示,其总反应式为Pb+PbO2+2H2SO4=2PbSO4+2H2O。下列判断不正确的是( )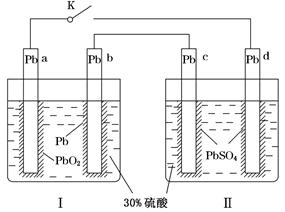
| A.闭合K时,d电极的反应式为PbSO4+2H2O-2e-=PbO2+4H++SO42— |
| B.当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol |
| C.闭合K时,Ⅱ中SO42—向c电极迁移 |
| D.闭合K一段时间后,Ⅱ可单独作为原电池,d电极为正极 |
下列防腐措施中,利用原电池反应使主要金属得到保护的是( )
| A.用氧化剂使金属表面生成致密稳定的氧化物保护膜 |
| B.在金属中加入一些铬或镍制成合金 |
| C.在轮船的壳体水线以下部分装上锌锭 |
| D.金属表面喷漆 |