题目内容
【题目】按要求填空。
(1)氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
①与汽油相比,氢气作为燃料的优点是_____________________(至少答出两点)。
②利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为____________。
(2)有机物M经过太阳光光照可转化成N,转化过程如下:
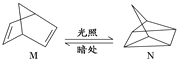 ΔH=+88.6 kJ·mol-1。则M、N相比,较稳定的是____________。
ΔH=+88.6 kJ·mol-1。则M、N相比,较稳定的是____________。
(3)火箭和导弹表面的薄层是耐高温物质。将石墨、铝粉和二氧化钛一定比例混合高温下煅烧,产物可作耐高温材料,4Al(s)+3TiO2(s)+3C(s)===2Al2O3(s)+3TiC(s)ΔH=-1 176 kJ·mol-1,则反应过程中,每转移1 mol电子放出的热量为______________。
(4)在一定温度下,4 L密闭容器内某一反应中气体M、气体N的物质的量随时间变化的曲线如图:
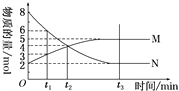
①该反应的化学方程式为____________________________。
②若t2=2 min,计算反应开始至t2时刻用M的浓度变化表示的平均反应速率为______________。
③t2时刻,反应物的转化率为______________。
【答案】 污染小;可再生;来源广;资源丰富;燃烧热值高(任写其中2个) 光能转化为化学能 M 98 kJ 2N![]() M 0.25 mol·L-1·min-1 75%
M 0.25 mol·L-1·min-1 75%
【解析】(1)①与汽油相比,氢气作为燃料的优点有污染小、可再生、来源广、资源丰富、燃烧热值高等,故答案为:污染小、可再生、来源广、资源丰富、燃烧热值高等;
②利用太阳能直接分解水制氢,是将光能转化为化学能,故答案为:将光能转化为化学能;
(2)有机物M经过太阳光光照可转化成N的△H=+88.6kJmol-1,过程是吸热反应,N暗处转化为M,是放热反应,能量越低越稳定,说明M稳定,故答案为:M;
(3)由反应可知,转移12mol电子放出1176kJ热量,则每转移1mol电子放出的热量为![]() =98kJ,故答案为:98kJ;
=98kJ,故答案为:98kJ;
(4)①由图象可以看出,反应中N的物质的量减小,M的物质的量增多,则N为反应物,M为生成物,且△n(N):△n(M)=6mol:3mol=2:1,则反应的化学方程式为:2N![]() M,故答案为:2N
M,故答案为:2N![]() M;
M;
②根据v=![]() 计算得M的平均化学反应速率为
计算得M的平均化学反应速率为 =0.25mol/(Lmin),故答案为:0.25mol/(Lmin);
=0.25mol/(Lmin),故答案为:0.25mol/(Lmin);
③根据图像可知,从反应开始N的物质的量在减小,所以N为反应物,N的转化率为![]() ×100%=75%,故答案为:75%。
×100%=75%,故答案为:75%。

 巧学巧练系列答案
巧学巧练系列答案 课课练江苏系列答案
课课练江苏系列答案