��Ŀ����
����Ŀ����֪�� C��s��+O2��g���TCO2��g����H1
CO2��g��+C��s���T2CO��g����H2
2CO��g��+O2��g���T2CO2��g����H3
4Fe��s��+3O2��g���T2Fe2O3��s����H4
3CO��g��+Fe2O3��s���T3CO2��g��+2Fe��s����H5
���й���������Ӧ�ʱ���ж���ȷ���ǣ� ��
A.��H1��0����H3��0
B.��H2��0����H4��0
C.��H1=��H2+��H3
D.��H3=��H4+��H5
���𰸡�C
���������⣺A�����е�ȼ�շ�Ӧ���ڷ��ȷ�Ӧ����ˡ�H1��0����H3��0����A���� B��̼��ԭ������̼�ķ�Ӧ�������ȷ�Ӧ����H2��0�����������ķ�Ӧ���ڷ��ȷ�Ӧ����H4��0����B����
C����֪����C��s��+O2��g���TCO2��g����H1��CO2��g��+C��s���T2CO��g����H2��2CO��g��+O2��g���T2CO2��g����H3 �� �ɸ�˹���ɿ�֪��=��+�ۣ���ˡ�H1=��H2+��H3 �� ��C��ȷ��
D����֪��2CO��g��+O2��g���T2CO2��g����H3��4Fe��s��+3O2��g���T2Fe2O3��s����H4��3CO��g��+Fe2O3��s���T3CO2��g��+2Fe��s����H5 �� �ɸ�˹���ɿ�֪��= ![]() ����
���� ![]() ��+�ݣ�����ˡ�H3=
��+�ݣ�����ˡ�H3= ![]() ��H4+
��H4+ ![]() ��H5 �� ��D����
��H5 �� ��D����
��ѡC��
A�����е�ȼ�շ�Ӧ���ڷ��ȷ�Ӧ��
B����̼��Ϊ��ԭ���ķ�Ӧͨ��Ϊ���ȷ�Ӧ�������������ڷ��ȷ�Ӧ��
C�����ݸ�˹�������üӺϷ����з�����
D�����ݸ�˹�������üӺϷ����з�����

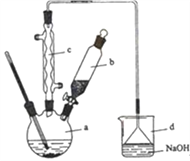
����Ŀ���屽��һ�ֻ���ԭ�ϣ�ʵ���Һϳ��屽��װ��ʾ��ͼ���й��������£������кϳɲ���ش����⣺
�� | �� | �屽 | |
�ܶ�/g��cm-3 | 0.88 | 3.10 | 1.50 |
�е�/��C | 80 | 59 | 156 |
ˮ���ܽ�� | �� | �� | �� |
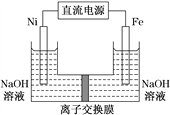
��1����a�м���15 mL��ˮ����������м����b��С�ļ���4.0 mLҺ̬�塣��a�е��뼸���壬�а�ɫ��������������Ϊ������_____���塣�����μ���Һ����ꡣװ��d��������________����ȡ�屽�Ļ�ѧ����ʽ____________________________��
��2��Һ�����������в�������ᴿ��
����a�м���10mLˮ��Ȼ����˳�ȥδ��Ӧ����м��
����Һ������10mLˮ��8mL10%��NaOH��Һ��10mLˮϴ�ӡ�NaOH��Һϴ�ӵ������ǣ�______��
����ֳ��Ĵ��屽�м�����������ˮ�Ȼ��ƣ����á����ˡ������Ȼ��Ƶ�Ŀ����_____��
��3�������Ϸ���������屽�л����е���Ҫ����Ϊ_______________��Ҫ��һ���ᴿ�����в����б������_________(������ȷѡ��ǰ����ĸ)��
A.�ؽᾧ B.���� C.���� D.��ȡ
��4��ȡ��Ӧ���ձ��е���Һ2 mL����������ϡ�����ữ���ٵ���AgNO3��Һ����dz��ɫ��������___(�ܻ���)֤������Һ�巴����ȡ����Ӧ��Ϊʲô? _______________________��