��Ŀ����
����Ŀ����ԭ�������ĵ��������ֶ�����Ԫ�أ�����ĸX��ʾ��ԭ�Ӱ뾶����Դ�С��������ۻ�����۵ı仯��ͼ��ʾ�� 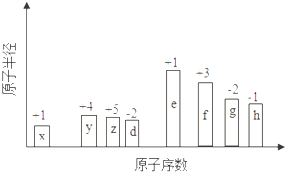
�����жϳ���Ԫ�ػش����⣺
��1��y��Ԫ������ �� ��λ��Ԫ�����ڱ��е����ڵ��壮
��2��h�����������Ļ�ѧʽΪ ��
��3��d��g����Ԫ�ص�����⻯�����ȶ��ԱȽ�ǿ�����ʣ���ṹʽ�� ��
��4��x��z��Ԫ�ؿ��γɺ���10�����ӵķ��ӣ��÷��ӵĵ���ʽΪ �� λ�ڵ�����������zͬ�����Ԫ�أ�����̬�⻯��Ļ�ѧʽΪ ��
��5��e��f ����Ԫ������������Ӧ��ˮ�������Ӧ�����ӷ���ʽΪ ��
��6����1mol e�ĵ���������d 2��ȼ�գ����ò����к��������ӵ���ĿΪ �� ���еĻ�ѧ��Ϊ �� a�����Ӽ� b�����Թ��ۼ� c���Ǽ��Թ��ۼ�
��7����x��d����Ԫ�ص�ԭ�Ӱ�1��1��ɵij���Һ̬�������ϡ��Һ�ױ����ֽ⣬��ʹ�õĴ���Ϊ������ţ� �� a��MnO2 b��FeCl3 c��Na2SO3 d��K2SO4 ��
���𰸡�
��1��̼������IVA
��2��Cl2O7
��3��H��O��H
��4��![]() ��AsH3
��AsH3
��5��OH��+Al��OH��3�TAlO2��+2H2O
��6��0.5NA��ac
��7��ab
���������⣺һ����˵�����Ӳ���Խ��ԭ�Ӱ뾶Խ��ͬһ����Ԫ��ԭ�Ӱ뾶����ԭ�������������С����������Ԫ����˵������������ϼ�=��������O��FԪ�س��⣩����������ϼ�=��������8������ͼ֪��x��y��z��d��e��f��g��h�ֱ���H��C��N��O��Na��Al��S��ClԪ�أ���1��y��CԪ�أ�����Ԫ��ԭ�Ӻ�����Ӳ���������������ͬ������������������������ͬ��Cԭ�Ӻ�����2�����Ӳ㡢������������4������Cλ�ڵڶ����ڵ�IVA�壬 ���Դ��ǣ�̼������IVA����2��h��ClԪ�أ�����������ϼ���+7�ۣ�����������OԪ�ػ��ϼ�Ϊ��2�ۣ����ݷ����и�Ԫ�ػ��ϼ۵Ĵ�����Ϊ0ȷ����ѧʽΪCl2O7 �� ���Դ��ǣ�Cl2O7����3��d��g�ֱ���O��SԪ�أ�Ԫ�صķǽ�����Խǿ���⻯����ȶ���Խǿ���ǽ�����O��S������ˮ���ȶ��Դ������⣬ˮ���ӽṹʽΪH��O��H�����Դ��ǣ�H��O��H����4��x��z�ֱ���H��NԪ�أ������γɵ�10���ӷ���Ϊ����������ʽΪ ![]() ��λ�ڵ�����������zͬ�����Ԫ����AsԪ�أ�As��HԪ���γɵ��⻯��Ͱ�����ѧʽ���ƣ�����ʽΪAsH3 ��
��λ�ڵ�����������zͬ�����Ԫ����AsԪ�أ�As��HԪ���γɵ��⻯��Ͱ�����ѧʽ���ƣ�����ʽΪAsH3 ��
���Դ��ǣ� ![]() ��AsH3����5��e��f ����Ԫ������������Ӧ��ˮ����ֱ���NaOH���������������߷�Ӧ����ƫ�����ƺ�ˮ�����ӷ���ʽΪOH��+Al��OH��3�TAlO2��+2H2O�����Դ��ǣ�OH��+Al��OH��3�TAlO2��+2H2O����6��e��d��Na��OԪ�أ���1mol e�ĵ���������d 2��ȼ�գ�������Ϊ�������ƣ�����Naԭ���غ�֪�����ɹ������Ƶ����ʵ���Ϊ0.5mol��ÿ����ѧʽ�к���1�����������ӣ��������������ʵ���Ϊ0.5mol������Ϊ0.5NA�����������������Ӻ���������֮��������Ӽ���O��Oԭ��֮����ڷǼ��Լ���
��AsH3����5��e��f ����Ԫ������������Ӧ��ˮ����ֱ���NaOH���������������߷�Ӧ����ƫ�����ƺ�ˮ�����ӷ���ʽΪOH��+Al��OH��3�TAlO2��+2H2O�����Դ��ǣ�OH��+Al��OH��3�TAlO2��+2H2O����6��e��d��Na��OԪ�أ���1mol e�ĵ���������d 2��ȼ�գ�������Ϊ�������ƣ�����Naԭ���غ�֪�����ɹ������Ƶ����ʵ���Ϊ0.5mol��ÿ����ѧʽ�к���1�����������ӣ��������������ʵ���Ϊ0.5mol������Ϊ0.5NA�����������������Ӻ���������֮��������Ӽ���O��Oԭ��֮����ڷǼ��Լ���
���Դ��ǣ�0.5NA��ac����7��x��d�ֱ���H��OԪ�أ���x��d����Ԫ�ص�ԭ�Ӱ�1��1��ɵij���Һ̬��������˫��ˮ��˫��ˮ��ϡ��Һ�ױ����ֽ�����������ˮ�����ö������̺��Ȼ�������������ѡab��

 ������ÿ�ʱ�Ż���ҵϵ�д�
������ÿ�ʱ�Ż���ҵϵ�д�