题目内容
【题目】下表是元素周期表的一部分,回答下列有关问题。
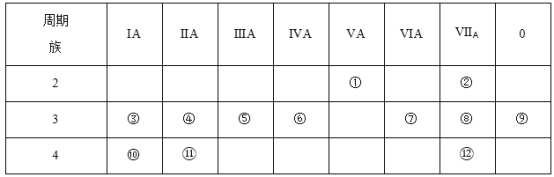
(1)写出下列元素符号:①__________,⑥__________,⑦__________,__________。
(2)在这些元素中,最活泼的金属元素是__________(填元素符号,下同),最活泼的非金属元素是__________,最不活泼的元素是__________。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的是__________(填化学式,下同),碱性最强的是__________,呈两性的氢氧化物是__________,写出这三者之间相互反应的化学方程式__________。
(4)在这些元素中(稀有气体元素除外),原子半径最小的是__________(填元素符号,下同),原子半径最大的是__________。
(5)在③与④中,相应单质化学性质较活泼的是__________(填元素符号),怎样用化学实验证明?__________。在⑧与中,相应单质化学性质较活泼的是__________(填元素符号),怎样用化学实验证明?_______。
【答案】NSiSCaKFArHClO4KOHAl(OH)3HClO4+KOH=KClO4+H2O、3HClO4+Al(OH)3=Al(ClO4)3+3H2O、KOH+Al(OH)3=KAlO2+2H2OFKNa把等质量的这两种物质分别放入冷水中,能够发生剧烈反应的是钠Cl向NaBr水溶液中通入Cl2,溶液变成红棕色
【解析】
根据元素在周期表中的相对位置首先判断出元素,然后结合元素周期律以及相关物质的性质分析解答。
由元素在周期表中位置,可知①为N、②为F、③为Na、④为Mg、⑤为Al、⑥为Si、⑦为S、⑧为Cl、⑨为Ar、⑩为K、为Ca、为Br。则
(1)由以上分析可知①为N、⑥为Si、⑦为S、为Ca;
(2)同周期自左向右金属性逐渐减弱,非金属性逐渐增强,同主族从上到下金属性逐渐增强,非金属性逐渐减弱,则在这些元素中,最活泼的金属元素是K,最活泼的非金属元素是F,最不活泼的元素是稀有气体元素Ar;
(3)非金属性越强,最高价含氧酸的酸性越强,金属性越强,最高价氧化物水化物的碱性越强,则在这些元素的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH,呈两性的氢氧化物是Al(OH)3,这三者之间相互反应的化学方程式为HClO4+KOH=KClO4+H2O、3HClO4+Al(OH)3=Al(ClO4)3+3H2O、KOH+Al(OH)3=KAlO2+2H2O;
(4)同周期自左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则在这些元素中(稀有气体元素除外),原子半径最小的是F,原子半径最大的是Na;
(5)同周期自左向右金属性逐渐减弱,在③与④中,相应单质化学性质较活泼的是Na,金属性越强,越容易与水反应,则把等质量的这两种物质分别放入冷水中,能够发生剧烈反应的是钠,即可证明。同主族从上到下非金属性逐渐减弱,在⑧与中,相应单质化学性质较活泼的是Cl,可以根据相互之间的置换反应证明非金属性强弱,即实验为向NaBr水溶液中通入Cl2,溶液变成红棕色。