题目内容
【题目】298 K 时,0.1 mol/L H2R溶液中H2R、HR、R2 三种微粒的分布系数δ随 pH 变化的关系如图所示。已知:298 K时,HF的Ka=1.0×103.4。下列表述正确的是
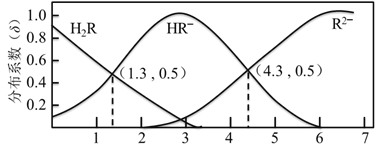
A. H2R的Ka1 = 1.0×101.3
B. Na2R 溶液中离子存在关系:c(Na+) = c(HR ) +2c(R2 )
C. 等物质的量的NaHR 和Na2R溶于水,所得溶液的pH 恰好为4.3
D. 在足量的NaF 溶液中加入少量 H2R 溶液:H2R + 2F = 2HF + R2
【答案】A
【解析】据图可知c(HR )= c(H2R ),pH =1.3,带入H2R的电离平衡计算公式Ka1= c(HR )×c(H+)/ c(H2R )= 1.0×101.3,A正确;Na2R 溶液水解显碱性,根据电荷守恒得到: c(Na+) + c(H+)= c(HR ) +2c(R2 )+ c(OH ),由于c(H+) < c(OH ),所以c(Na+) >c(HR ) +2c(R2 ),B错误;据图已知c(HR )= c(R2 )、pH =4.3,带入HR电离平衡计算公式Ka2= c(H+)×c(R2 )/ c(HR )=1×10-4.3,等物质的量的NaHR 和Na2R溶于水所得溶液中显酸性,c(R2 )> c(HR ),所以c(H+)<1×10-4.3mol/L,pH 大于4.3,C错误;HF的Ka大于H2R的Ka2而小于Ka1,由强酸制备弱酸可知,反应应为H2R + F = HF + HR, D错误;正确选项A。

练习册系列答案
相关题目