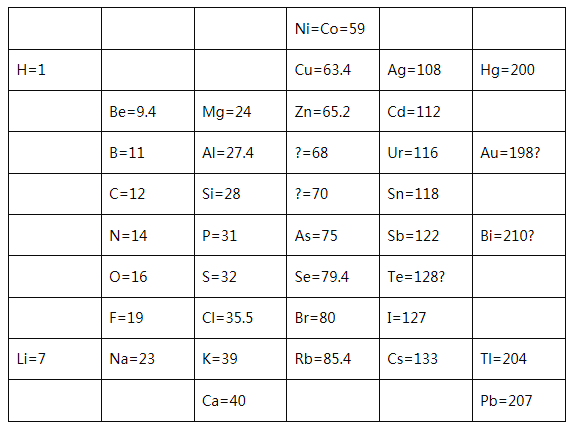
��Ŀ����
����Ŀ��ij�Ż��������Ҫ�ɷ���FexS(SΪһ2�ۣ����Ⱥ���Fe2+�ֺ���Fe3+����һ�����ĸôŻ�������100mL������ǡ����ȫ��Ӧ(ע:��ʯ�������ɷֲ������ᷴӦ������������2.4g��FeCl20.425 mol��һ����H2S���壬����Һ����Fe3+��������˵����ȷ���ǣ� ��
A. 100 mL��������HC1���ʵ���Ũ��Ϊ8��5 mol/L
B. ���ɵ�H2S�����ڱ�״���µ����Ϊ5.6L
C. �ôŻ�����FexS�У�Fe2+��Fe3+�����ʵ���֮��Ϊ3 : 1
D. �������FexS��x=0��15
���𰸡�A
��������
A��������ԭ���غ���������Ũ�ȣ�B��������ԭ���غ��������������C������ת�Ƶ����غ����Fe2+��Fe3+�����ʵ���֮�ȣ� D������ת�Ƶ����غ����n��Fe3+����������ԭ���غ����n��Fe2+����������ԭ���غ㼰���ʼ�����ԭ�ӵ����ʵ������Ӷ��ó�xֵ��
n��S��=![]() =0.075mol������ת�Ƶ����غ��n��Fe3+��=
=0.075mol������ת�Ƶ����غ��n��Fe3+��=![]() =0.15mol����n��Fe2+��=0.425mol-0.15mol=0.275mol������Fe2+��Fe3+�����ʵ���֮��=0.275mol��0.15mol=11��6��A������ǡ�÷�Ӧ����FeCl2 0.425mol��������ԭ���غ��c��HCl��=
=0.15mol����n��Fe2+��=0.425mol-0.15mol=0.275mol������Fe2+��Fe3+�����ʵ���֮��=0.275mol��0.15mol=11��6��A������ǡ�÷�Ӧ����FeCl2 0.425mol��������ԭ���غ��c��HCl��=![]() =8.5mol/L��ѡ��A��ȷ��B��������ԭ�ӡ���ԭ���غ��n��H2S��=
=8.5mol/L��ѡ��A��ȷ��B��������ԭ�ӡ���ԭ���غ��n��H2S��=![]() n��HCl��=n��FeCl2��=0.425mol��V��H2S��=0.425mol��22.4L/mol=9.52L��ѡ��B����C������ת�Ƶ����غ��n��Fe3+��=
n��HCl��=n��FeCl2��=0.425mol��V��H2S��=0.425mol��22.4L/mol=9.52L��ѡ��B����C������ת�Ƶ����غ��n��Fe3+��=![]() =0.15mol����n��Fe2+��=0.425mol-0.15mol=0.275mol������Fe2+��Fe3+�����ʵ���֮��=0.275mol��0.15mol=11��6��ѡ��C����D��FexS��n��S��=0.075mol+0.425mol=0.5mol��n��Fe��=0.425mol������n��Fe����n��S��=0.425mol��0.5mol=0.85������x=0.85��ѡ��D����ѡA��
=0.15mol����n��Fe2+��=0.425mol-0.15mol=0.275mol������Fe2+��Fe3+�����ʵ���֮��=0.275mol��0.15mol=11��6��ѡ��C����D��FexS��n��S��=0.075mol+0.425mol=0.5mol��n��Fe��=0.425mol������n��Fe����n��S��=0.425mol��0.5mol=0.85������x=0.85��ѡ��D����ѡA��