题目内容
【题目】元素是构成我们生活的世界中一切物质的“原材料”。
(1)1869年,门捷列夫在前人研究的基础上制出了第一张元素周期表,如图所示。
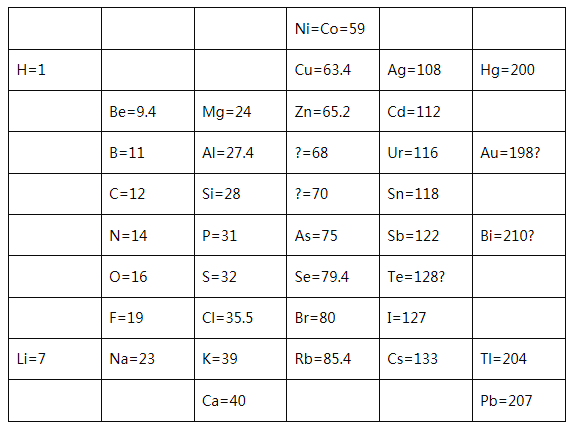
①门捷列夫将已有元素按照相对原子质量排序,同一_________(填“横行”或“纵列”)元素性质相似。结合表中信息,猜想第4列方框中“?=70”的问号表达的含义是______,第5列方框中“Te=128?”的问号表达的含义是________。
②到20世纪初,门捷列夫周期表中为未知元素留下的空位逐渐被填满。而且,随着原子结构的逐渐揭秘,科学家们发现了元素性质不是随着相对原子质量递增呈现周期性变化,而是随着原子序数(核电荷数)递增呈现周期性变化。其本质原因是_____(填字母序号)。
A. 随着核电荷数递增,元素主要化合价呈现周期性变化
B. 随着核电荷数递增,原子核外电子排布呈现周期性变化
C. 随着核电荷数递增,原子半径呈现周期性变化
(2)短周期元素A、B、D、E、G、J在周期表中的位置如下:
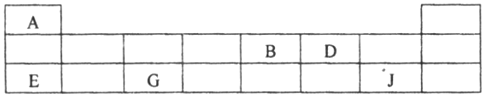
根据上表回答问题:
①第三周期的四种元素中离子半径最小的是_________ (用元素符号填答)。
②B、D的非金属性由大到小的顺序是__________ (用元素符号填答)。
③E、G、J的最高价氧化物对应水化物两两之间反应的离子方程式分别为i.H++OH-=H2O、ii.___、iii.___。
④用电子式表示A2D形成过程_______________。
(3)元素Y的一种含氧酸化学式为 H3YO3,其结构式可表示为:![]() 。该酸为______元酸,请写出该酸与过量氢氧化钠溶液反应的化学方程式_____。(用对应元素符号填答)(已知信息:氢氧原子结合成的一种原子团“—OH”叫羟基,含氧酸中只有羟基氢才可电离出 H+。)
。该酸为______元酸,请写出该酸与过量氢氧化钠溶液反应的化学方程式_____。(用对应元素符号填答)(已知信息:氢氧原子结合成的一种原子团“—OH”叫羟基,含氧酸中只有羟基氢才可电离出 H+。)
【答案】横行 预测此处应有一个相对原子质量为70的元素 怀疑Te的相对原子质量(或同一列相对原子质量依次增大,按此规律,Te的相对原子质量应该在122和127之间) B Al3+ O>N Al(OH)3+OH-=AlO2-+2H2O Al(OH)3+3H+=Al3++3H2O ![]() 二 H3PO3+2NaOH=Na2HPO3+2H2O
二 H3PO3+2NaOH=Na2HPO3+2H2O
【解析】
(1)①根据上表可知,门捷列夫将已有元素按照相对原子质量排序,同一横行的元素性质相似。结合表中信息,猜想第4列方框中“?=70”的问号表示预测此处应有一个相对原子质量为70的元素;第5列方框中“Te=128?”的问号表示怀疑Te的相对原子质量(或同一列相对原子质量依次增大,按此规律,Te的相对原子质量应该在122和127之间),故答案为:横行;预测此处应有一个相对原子质量为70的元素;怀疑Te的相对原子质量(或同一列相对原子质量依次增大,按此规律,Te的相对原子质量应该在122和127之间)。
②元素性质不是随着相对原子质量递增呈现周期性变化,而是随着原子序数(核电荷数)递增呈现周期性变化,其本质原因是随着核电荷数递增,原子核外电子排布呈现周期性变化,故B正确,故答案为:B。
(2)由短周期元素A、B、D、E、G、J在周期表中的位置可以知道A、B、D、E、G、J分别为H、N、O、Na、Al、Cl。
①第三周期的三种元素形成的三种离子分别为Na+、Al3+、Cl-,电子层数越多,半径越大,具有相同电子层结构的离子,核电荷数越大,半径越小,所以这三种离子中离子半径最小的是Al3+,故答案为:Al3+。
②B、D为同一周期的元素,同一周期的元素,从左向右,非金属性逐渐增强,非金属性由大到小的顺序是O>N,故答案为:O>N。
③E、G、J的最高价氧化物对应水化物分别为NaOH、Al(OH)3、HClO4,Al(OH)3为两性氢氧化物,既能与酸反应又能与强碱反应,两两之间反应的离子方程式分别为H++OH-=H2O、Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O、Al(OH)3+3H+=Al3++3H2O。
④A2D为H2O,用电子式表示其形成过程为:![]() ,故答案为:
,故答案为:![]() 。
。
(3)从结构式![]() 可知,该分子中含有2个羟基,故该酸为二元酸,该酸与过量的氢氧化钠反应的化学方程式为:H3PO3+2NaOH=Na2HPO3+2H2O,
可知,该分子中含有2个羟基,故该酸为二元酸,该酸与过量的氢氧化钠反应的化学方程式为:H3PO3+2NaOH=Na2HPO3+2H2O,
故答案为:二、H3PO3+2NaOH=Na2HPO3+2H2O。


