题目内容
【题目】Ⅰ.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平。下列资料表示了三种金属被人类开发利用的大致年限。
![]()
(1)上述资料中的三种常用金属的开发利用之所以有先后,主要取决于________。
A.金属的导电性强弱 B.金属在地壳中的含量多少
C.金属的化合价高低 D.金属的活动性大小
(2)早在西汉成书的《淮南万毕术》里,就有“曾青得铁则化为铜”的记载。曾青又有空青、白青、石胆、胆矾等名称,其实都是天然的硫酸铜。
①写出“曾青得铁则化为铜”的化学方程式_________________________________________________。
②若根据上述反应设计成原电池,请在方框中画出原电池的装置图,标出正、负极和电解质溶液,并写出电极反应式。
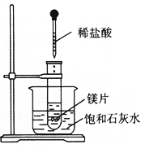

正极反应: _______________________________________;
负极反应: _______________________________________。
Ⅱ.在一只试管中放入几小块镁片,把试管放入盛有25 ℃的饱和石灰水
的烧杯中,用胶头滴管滴5 mL盐酸于试管中。试回答下列问题:
(1)实验中产生的现象是:____________________________________________________________。
(2)写出有关的化学方程式:____________________________________________________________。
(3)由实验推知:MgCl2溶液与H2的总能量________(填“<”“>”或“=”) Mg片和盐酸的总能量。
【答案】Ⅰ.(1)D (2)①Fe+CuSO4=Cu+FeSO4 ② (2分)
(2分)
Cu2++2e-=Cu Fe-2e-=Fe2+ Ⅱ.(1)镁片逐渐溶解,有大量气泡产生,烧杯中有固体析出 (2分)
(2)Mg+2HCl=MgCl2+H2↑ (3)<
【解析】
试题分析:(1)根据示意图可判断金属的开发利用之所以有先后,主要取决于金属的活动性大小,答案选D。
(2)早在西汉成书的《淮南万毕术》里,就有“曾青得铁则化为铜”的记载。曾青又有空青、白青、石胆、胆矾等名称,其实都是天然的硫酸铜。
①铁与硫酸铜发生置换反应的化学方程式为Fe+CuSO4=Cu+FeSO4。
②根据方程式可知铁失去电子,铜离子得到电子,则铁是负极,铜或者石墨等是正极,硫酸铜溶液作电解质溶液,装置图为(见答案)。其中正极反应式为Cu2++2e-=Cu,负极反应式为Fe-2e-=Fe2+。
Ⅱ.在一只试管中放入几小块镁片,把试管放入盛有25 ℃的饱和石灰水
的烧杯中,用胶头滴管滴5 mL盐酸于试管中。试回答下列问题:
(1)镁和盐酸反应产生氯化镁和氢气,反应放热,而氢氧化钙的溶解度所温度的升高而减小,因此实验中产生的现象是镁片逐渐溶解,有大量气泡产生,烧杯中有固体析出。
(2)有关的化学方程式为Mg+2HCl=MgCl2+H2↑。
(3)反应放热,则MgCl2溶液与H2的总能量<Mg片和盐酸的总能量。

 阅读快车系列答案
阅读快车系列答案【题目】在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的主要作用力依次是
A.范德华力、范德华力、氢键
B.范德华力、范德华力、共价键
C.共价键、共价键、共价键
D.范德华力、氢键、共价键
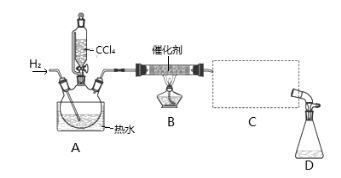
【题目】氯仿(CHCl3)常用作有机溶剂和麻醉剂,常温下在空气中易被氧化。实验室中可用热还原CCl4法制备氯仿,装置示意图及有关数据如下:
物质 | 相对分子质量 | 密度/(g·mL-1) | 沸点/℃ | 水中溶解性 |
CHCl3 | 119.5 | 1.50 | 61.3 | 难溶 |
CCl4 | 154 | 1.59 | 76.7 | 难溶 |
实验步骤:
①检验装置气密性;②开始通入H2; ③点燃B处酒精灯;
④向A处水槽中加入热水,接通C处冷凝装置的冷水; ⑤向三颈瓶中滴入20 mLCCl4;
⑥反应结束后,停止加热,将D处锥形瓶中收集到的液体分别用适量NaHCO3溶液和水洗涤,分出的产物加入少量无水CaCl2固体,静置后过滤;
⑦对滤液进行蒸馏纯化,得到氯仿15 g。请回答:
(1)若步骤②和步骤③的顺序颠倒,则实验中产生的不良后果可能为 。
(2)B处中发生主要反应的化学方程式为 。
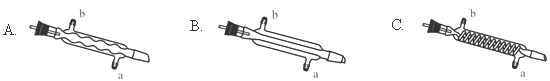
(3)C处中应选用的冷凝管为 (填选项字母);冷水应从该冷凝管的 (填“a”或“b”)口接入。
(4)步骤⑥中,用水洗涤的目的为 。
(5)该实验中,氯仿的产率为 。
(6)氯仿在空气中能被氧气氧化生成HCl和光气(COCl2),该反应的化学方程式为 。



