题目内容
有①Na2CO3溶液②CH3COONa溶液 ③NaOH溶液 ④CH3COONH4溶液各25mL。物质的量浓度均为0.1mol·L-1,下列说法正确的是 ( )
| A.四种溶液的pH大小顺序是③>②>①>④ |
| B.若分别加入25mL 0.1mol·L-1盐酸充分反应后,pH最大的是① |
| C.若将四种溶液稀释相同倍数,pH变化最大的是④ |
| D.升高温度,四种溶液的pH均减小 |
B
试题分析:碳酸钠水解溶液显碱性,醋酸钠也水解溶液显碱性,但由于醋酸的酸性强于碳酸的,因此碳酸钠溶液的碱性强于醋酸钠的。氢氧化钠是强碱,醋酸铵水解相互促进,溶液显中性,所以四种溶液的pH大小顺序是③>①>②>④,A不正确;若分别加入25mL 0.1mol·L-1盐酸充分反应,则①中恰好生成碳酸氢钠,②中生成CO2、水和氯化钠。③中恰好生成氯化钠,④中生成醋酸和氯化铵,所以pH最大的是①。B正确;稀释促进盐类的水解,因此若将四种溶液稀释相同倍数,pH变化最大的是③,C不正确;升高温度,促进水解,所以①②的pH增大,D不正确,答案选B。
点评:该题属于中等难度的试题,考查的知识面比较广泛,对学生的要求较高。既要掌握牢固的基础知识,更要能够熟练的运用所学的只是去解决实际问题。

练习册系列答案
相关题目
 溶液的
溶液的 ,则该溶液中
,则该溶液中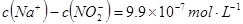
 溶液与
溶液与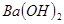 溶液反应至中性的离子方程式为:
溶液反应至中性的离子方程式为: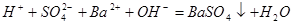
 ;②
;②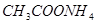 ;③
;③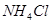 ;④
;④ ,四种溶液中
,四种溶液中 比较:②
比较:② ①
①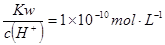 的溶液:
的溶液: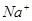 、
、 、
、 、
、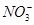 可以常量共存
可以常量共存