题目内容
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用元素符号、离子符号或化学式回答下列问题: 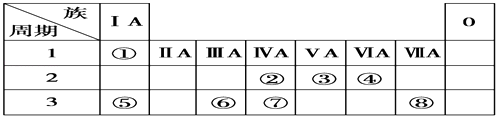
(1)④、⑥、⑧的原子半径由大到小的顺序是:(请用>、<表示) .
(2)②、③、⑧的最高价含氧酸的酸性由强到弱的顺序是: .
(3)请写出由②、④、⑦三种元素的氢化物稳定性由弱到强的顺序是: .
(4)⑤、⑥两种元素的最高价氧化物对应的水化物在溶液中相互反应的离子方程式是: .
(5)由表中两种元素的原子按1:1组成的一种常见液态化合物的稀溶液易被 催化分解,可使用的催化剂为(填序号) .
a.KMnO4b.MnO2c.Na2SO3 .
【答案】
(1)r(Al)>r(o)>r(Cl)
(2)HClO4>HNO3>H2CO3
(3)SiH4<CH4<H2O
(4)Al(OH)3+OH﹣=[Al(OH)4]﹣
(5)b
【解析】解:根据元素所在周期表中的位置,可知元素的种类,①为H元素,②为C元素,③为N元素,④为O元素,⑤为Na元素,⑥为Al元素,⑦为Si元素,⑧为Cl元素,(1)Cl与Al同周期,周期表中,同周期元素从左到右原子半径逐渐减小,则原子半径Al>Cl,原子核外电子层数越多,半径越大,则有原子半径Al>Cl>O, 所以答案是:r(Al)>r(o)>r(Cl);(2)②、③、⑧对应的元素分别为C、N、Cl,非金属性:Cl>N>C,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则HClO4>HNO3>H2CO3 ,
所以答案是:HClO4>HNO3>H2CO3;(3)②、④、⑦三种元素的非金属性O>C>Si,非金属性越强氢化物越稳定,所以三种元素的氢化物由弱到强的顺序是SiH4<CH4<H2O,所以答案是:SiH4<CH4<H2O;(4)⑤、⑥两种元素的最高价氧化物对应的水化物分别为NaOH、氢氧化铝,二者反应生成偏铝酸钠与水;反应离子方程式为:Al(OH)3+OH﹣═AlO2﹣+2H2O,
所以答案是:Al(OH)3+OH﹣═AlO2﹣+2H2O.(5)两种元素的原子按1:1组成的常见液态化合物为H2O2 , 在MnO2或FeCl3催化作用下分解,而Na2SO3具有还原性,与H2O2发生氧化还原反应,不能用作催化剂,高锰酸钾具有强氧化性,与H2O2发生氧化还原反应,也不能作催化剂,
所以答案是:b.

【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”,进行了如下实验:
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
1 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
2 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
3 | 1.0 | a | 3.0 | 2.0 | 5.6 |
4 | |||||
请回答:
(1)已知KMnO4酸性溶液与H2C2O4溶液反应有CO2生成,用化学方程式表示该实验的实验原理________________________________________。
(2)a=______,设计实验2、3的目的是______________________
(3)利用实验2中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=____________。
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。

①该同学绘制图1的依据是________________________________________
②该小组同学提出的假设是_________________________________________
③请你帮助该小组同学完成实验方案,并填写表中空白。
实 验 编 号 | 室温下,试管中所加试剂及其用量/mL | 再向试 管中加 入少量 固体 | 室温下 溶液颜 色褪至 无色所 需时间 /min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
④若该小组同学提出的假设成立,则其依据是__________________________________
