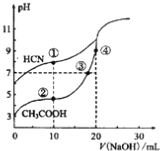
题目内容
【题目】在恒温、恒容的容器中进行反应:2HIH2+I2(正反应为吸热反应),反应物的浓度由0.1mol/L降到0.06mol/L需要20s,那么由0.06mol/L降到0.036mol/L所需时间为( )
A.等于10 s
B.等于12 s
C.大于12 s
D.小于12 s
【答案】C
【解析】解:前20s反应H22H的平均反应速率为: v= ![]() =0.002mol/(Ls),
=0.002mol/(Ls),
反应物浓度由0.06mol/L降到0.036mol/L,浓度变化为:0.06mol/L﹣0.036mol/L=0.024mol/L,
按照前20s的平均反应速率计算,反应消耗的时间为: ![]() =12s,
=12s,
由于反应物浓度越小,反应速率越小,所以反应需要的时间大于12s,
故选C.
先根据v= ![]() 计算出20s内的平均反应速率,再利用此反应速率计算出反应物浓度由0.06mol/L降到0.036mol/L的浓度变化消耗的反应时间,由于反应物浓度减小,反应速率减小,反应消耗的时间越大.
计算出20s内的平均反应速率,再利用此反应速率计算出反应物浓度由0.06mol/L降到0.036mol/L的浓度变化消耗的反应时间,由于反应物浓度减小,反应速率减小,反应消耗的时间越大.

 名校课堂系列答案
名校课堂系列答案【题目】根据题意解答
(1)Zn粒和稀盐酸反应一段时间后,反应速率会减慢,当加热或加入浓盐酸后,反应速率明显加快.由此判断,影响化学反应速率的因素有和
(2)为探究锌与盐酸反应过程的速率变化,某同学的实验测定方法是:在100ml稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(氢气体积已换算为标准状况):
时间/min | 1 | 2 | 3 | 4 | 5 |
体积/mL | 50 | 120 | 232 | 290 | 310 |
①哪一时间段反应速率最大(填“0~1min”或“1~2min”或“2~3min”或“3~4min”或“4~5min”).
②2~3min时间段以盐酸的浓度变化来表示的该反应速率(设溶液体积不变)为 .
③试分析1~3min时间段里,反应速率变大的主要原因 .
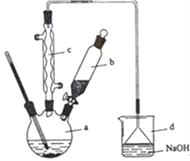
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/°C | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了_____气体。继续滴加至液溴滴完。装置d的作用是________;制取溴苯的化学方程式____________________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是:______。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_____;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为_______________,要进一步提纯,下列操作中必须的是_________(填入正确选项前的字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)取反应后烧杯中的溶液2 mL加入足量的稀硝酸酸化,再滴入AgNO3溶液,有浅黄色沉淀生成___(能或不能)证明苯与液溴反生了取代反应,为什么? _______________________。