题目内容
【题目】滴定原理在中学化学实验中有着极为重要的应用,现欲采用滴定的方法测定样品中硫酸亚铁的质量分数(约45%),根据反应:
2KMnO4+10FeSO4+8H2SO4 ═ 2MnSO4+5Fe2(SO4)3+K2SO4+8H2O。
步骤如下:
①称量样品3.0 g配成100 mL溶液;
②取20.00 mL待测液,置于锥形瓶中,再加入适量硫酸;
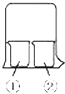
③将0.1 mol/L的标准KMnO4溶液装入滴定管,调节液面至a mL处(见下图);

④滴定待测液至滴定终点时,滴定管液面读数为6;
⑤重复滴定2~3次;
⑥计算。
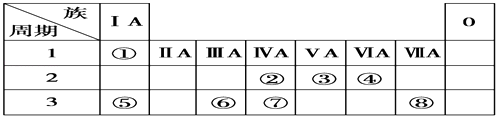
(1)实验步骤③中的溶液体积读数为________mL。
(2)实验步骤①、③中还需要使用的最主要的仪器分别为:①________、③________。
(3)在步骤④的滴定操作中是否需要在待测液中加入指示剂________。(填“是”或“否”)
(4)若滴定时每次消耗KMnO4溶液体积的平均值为V mL,则绿矾样品的纯度为________。(列出算式即可)如果步骤③中读数时俯视,则最终结果________。(填“偏大”、“不变”或“偏小”)
【答案】 1.00 托盘天平、100mL容量瓶 酸式滴定管 否 ![]() 偏大
偏大
【解析】(1)根据图象分析,目光要与凹液面相切,则读数为:1.00mL,故答案为:1.00;
(2)称量样品3.0g配成100mL溶液,称量要用到托盘天平,配制100mL溶液要用到100mL容量瓶;高锰酸钾溶液要用酸式滴定管量取;故答案为:托盘天平、100mL容量瓶;酸式滴定管;
(3)高锰酸钾为紫色溶液,自身可以作指示剂,所以不需要加入指示剂,故答案为:否;
(4)5Fe2+ + MnO4-+8H+═5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.1mol/L×V×10-3L
则n(Fe2+)=5×0.1V×10-3mol,则100mL溶液中含Fe2+=5×0.1V×10-3mol×![]() =5×0.1V×10-3×5mol,所以绿矾样品的纯度为
=5×0.1V×10-3×5mol,所以绿矾样品的纯度为![]() ×100%;步骤③中读数时俯视,则滴定前的读数偏小,滴定消耗的体积等于滴定后的读数减去滴定前的读数,所以滴定消耗的体积偏大,则计算出硫酸亚铁的物质的量偏大,最终结果偏大,故答案为:
×100%;步骤③中读数时俯视,则滴定前的读数偏小,滴定消耗的体积等于滴定后的读数减去滴定前的读数,所以滴定消耗的体积偏大,则计算出硫酸亚铁的物质的量偏大,最终结果偏大,故答案为: ![]() ×100%;偏大。
×100%;偏大。

 名题金卷系列答案
名题金卷系列答案