题目内容
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”,进行了如下实验:
实验 编号 | 室温下,试管中所加试剂及其用量/mL | 室温下溶液颜色褪至无色所需时间/min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
1 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
2 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
3 | 1.0 | a | 3.0 | 2.0 | 5.6 |
4 | |||||
请回答:
(1)已知KMnO4酸性溶液与H2C2O4溶液反应有CO2生成,用化学方程式表示该实验的实验原理________________________________________。
(2)a=______,设计实验2、3的目的是______________________
(3)利用实验2中数据计算,用KMnO4的浓度变化表示的反应速率为v(KMnO4)=____________。
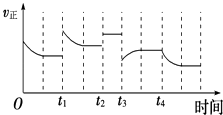
(4)该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图1所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的趋势应如图2所示。该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究。

①该同学绘制图1的依据是________________________________________
②该小组同学提出的假设是_________________________________________
③请你帮助该小组同学完成实验方案,并填写表中空白。
实 验 编 号 | 室温下,试管中所加试剂及其用量/mL | 再向试 管中加 入少量 固体 | 室温下 溶液颜 色褪至 无色所 需时间 /min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
4 | 3.0 | 2.0 | 3.0 | 2.0 | t | |
④若该小组同学提出的假设成立,则其依据是__________________________________
【答案】 2KMnO4 + 5H2C2O4 +3H2SO4 =2MnSO4 + K2SO4 +10CO2↑ +8H2O 4.0 探究H2C2O4 浓度对反应速率的影响 0.015 mol/(L·min) 随着反应的进行,反应物浓度逐渐减小,速率降低 生成的Mn2+起催化作用,加快反应 MnSO4
【解析】(1)酸性高锰酸钾溶液可以将草酸氧化为二氧化碳,本身被还原为Mn2+,所以反应为:2KMnO4 + 5H2C2O4 +3H2SO4 =2MnSO4 + K2SO4 +10CO2↑ +8H2O。
(2)对于实验2、3可以看出,其他反应物相同,只有草酸用量发生变化,所以这两个实验探究的是H2C2O4 浓度对反应速率的影响,因此实验中必须保证硫酸和高锰酸钾的浓度不变,所以必须保证总体积是相等的。实验2的总体积为10mL,所以实验3总体积也是10mL,计算可得a=4.0mL。
(3)实验2中高锰酸钾的初始浓度为0.2 mol/L × 3 mL÷ 10 mL = 0.06 mol/L,溶液褪色代表高锰酸钾被完全反应,所以速率为0.06 mol/L ÷ 4 min = 0.015 mol/(L·min)。
(4)①随着反应的进行,反应物浓度逐渐减小,反应速率应该逐渐降低,所以图像中n(Mn2+)随时间变化的趋势越来越平缓,最后保持不变。
②该反应速率先加快后减慢,所以可以假设是反应生成的Mn2+对反应起到了催化作用,导致反应加快,反应后期反应物的浓度减小,所以反应减慢。
③本实验的目的是验证Mn2+对反应可以起到催化作用,所以加入少量的硫酸锰固体。
④若假设成立,则反应加快,褪色用的时间应该小于4min。

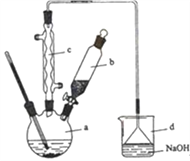
【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:按下列合成步骤回答问题:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/°C | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
(1)在a中加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白色烟雾产生,是因为生成了_____气体。继续滴加至液溴滴完。装置d的作用是________;制取溴苯的化学方程式____________________________。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是:______。
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是_____;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为_______________,要进一步提纯,下列操作中必须的是_________(填入正确选项前的字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)取反应后烧杯中的溶液2 mL加入足量的稀硝酸酸化,再滴入AgNO3溶液,有浅黄色沉淀生成___(能或不能)证明苯与液溴反生了取代反应,为什么? _______________________。