题目内容
【题目】为检验下列物质是否已被氧化,所选试剂(括号内物质)不正确的是( )
A.氯化亚铁溶液(硫氰化钾溶液)
B.碘化钾溶液(淀粉溶液)
C.乙醛(紫色石蕊试液)
D.亚硫酸钠溶液(氯化钡溶液)
【答案】D
【解析】A中若已有Fe2+氧化成了Fe3+ , 加KSCN溶液显血红色;B中若已有I-氧化成了I2 , 加淀粉变蓝色;C中若已有乙醛氧化成了乙酸,加紫色石蕊试液变红色;D中的BaSO3和BaSO4均是白色沉淀,D不正确。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】实验室制乙酸乙酯得主要装置如图1所示,主要步骤①在a试管中按2:3:2的体积比配制浓硫酸、乙醇、乙酸的混合物;
②按A图连接装置,使产生的蒸气经导管通到b试管所盛的饱和碳酸钠溶液(加入几滴酚酞试液)中;
③小火加热a试管中的混合液;
④等b试管中收集到约2mL产物时停止加热.撤下b试管并用力振荡,然后静置待其中液体分层;
⑤分离出纯净的乙酸乙酯.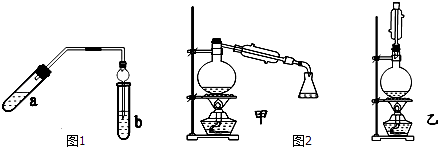
请回答下列问题:
(1)步骤④中可观察到b试管中有细小的气泡冒出,写出该反应的离子方程式: .
(2)A装置中使用球形管除起到冷凝作用外,另一重要作用是 , 步骤⑤中分离乙酸乙酯必须使用的一种仪器是 .
(3)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用如图A所示装置进行了以下4个实验.实验开始先用酒精灯微热3min,再加热使之微微沸腾3min.实验结束后充分振荡小试管b再测有机层的厚度,实验记录如下:
实验编号 | 试管a中试剂 | 试管b中试剂 | 测得有机层的厚度/cm |
A | 3mL乙醇、2mL乙酸、1mL18molL﹣1 浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
B | 3mL乙醇、2mL乙酸 | 0.1 | |
C | 3mL乙醇、2mL乙酸、6mL 3molL﹣1 H2SO4 | 1.2 | |
D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用.实验D中应加入盐酸的体积和浓度分别是mL和molL﹣1 .
②分析实验(填实验编号)的数据,可以推测出浓H2SO4的吸水性提高了乙酸乙酯的产率.浓硫酸的吸水性能够提高乙酸乙酯产率的原因是 .
③加热有利于提高乙酸乙酯的产率,但实验发现温度过高乙酸乙酯的产率反而降低,可能的原因是 .
④分离出乙酸乙酯层后,经过洗涤杂质;为了干燥乙酸乙酯可选用的干燥剂为(填字母) .
A.P2O5 B.无水Na2SO4 C.碱石灰 D.NaOH固体
⑤为充分利用反应物,该同学又设计了图2中甲、乙两个装置(利用乙装置时,待反应完毕冷却后,再用饱和碳酸钠溶液提取烧瓶中的产物).你认为更合理的是 . 理由是: .
【题目】X、T、Y、Z为1﹣36号元素,且原子序数依次增大,四种元素的性质或结构信息如表.请根据信息回答下列问题.
元素 | T | X | Y | Z |
性质结构信息 | 原子核外s电子总数等于p电子总数;人体内含量最多的元素,且其单质是常见的助燃剂 | 单质为双原子分子,分子中含有3对共用电子对,常温下单质性质稳定,但其原子较活泼 | 第3周期元素的简单离子中半径最小 | 第4周期元素,M电子层为全充满状态,最外层只有一个电子的原子 |
(1)写出元素T的离子结构示意图;写出元素X的气态氢化物的电子式;X形成的单质分子,含个σ键,个π键.写出Z元素原子的外围电子排布式;元素Y的原子核外共有种形状不同的电子云.
(2)Y单质与氢氧化钠溶液反应的离子方程式: .
(3)元素T与氟元素相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是(填序号字母).
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目.
【题目】氨的合成原理为:N2(g)+3H2(g)2NH3(g);△H=﹣92.4KJmol﹣1 . 现在500℃、20MPa时,将N2、H2置于一个容积为2L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图. 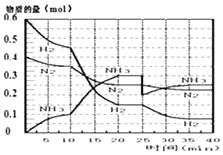
回答下列问题:
(1)10min内以NH3表示的平均反应速率;
(2)在10~20min内:NH3浓度变化的原因可能是;
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加NH3物质的量
(3)第1次平衡的时间范围为: , 第1次平衡:平衡常数K1=(带数据的表达式),
(4)在反应进行至25min时:
①曲线发生变化的原因:
②达第二次平衡时,新平衡的平衡常数K2K1(填“大于”、“等于”、“小于”);
(5)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:N2(g)+3H2O(1)2NH3(g)+ ![]() O2(g);△H=a kJmol﹣1
O2(g);△H=a kJmol﹣1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
T/K | 303 | 313 | 323 |
NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 |
此合成反应的a0;△S0,(填“>”、“<”或“=”).