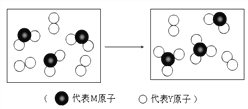
题目内容
【题目】X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16,在适当条件下三种单质两两直接化合,可发生如图所示变化.已知一个B分子中含有Z元素的原子个数比C分子中的Z元素的原子个数少一个.请回答下列问题:
(1)Y元素在周期表中的位置为 .
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入的物质名称是负极电极反应式为 .
(3)X、Y、Z三种元素可组成一种强酸W,C在适当条件下被W溶液吸收生成一种盐.该盐水溶液pH7(填“大于”、“小于”或“等于”),其原因是(用离子方程式表示):该溶液中所有离子浓度大小顺序为 .
(4)试写出实验室制取C的化学方程式 . 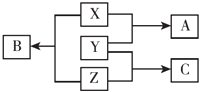
【答案】
(1)第二周期VA族
(2)氧气;H2+2OH﹣﹣2e﹣=2H2O
(3)小于;NH4++H2O?NH3?H2O+H+;c(NO3﹣)>c(NH4+)>c(H+)>c(OH﹣)
(4)2NH4Cl+Ca(OH)2 ![]() CaCl2+2H2O+2NH3↑
CaCl2+2H2O+2NH3↑
【解析】解:短周期中形成无色气体单质的只有H2、N2、O2(稀有气体除外),三元素的质子数之和为16,三种单质相互化合可以得到NO、H2O、NH3 , 且一个B分子中含有的Z原子个数比C分子中少1个,则B为H2O、C为NH3、Z为氢,由转化关系可知,故A为NO,X为氧,Y为氮,(1)Y为氮元素是7号元素,位于周期表中第二周期VA族,故答案为:第二周期VA族;(2)X的单质为氧气与Z的单质为氢气,形成原电池反应负极上是氢气失电子发生氧化反应在碱溶液中生成水,正极是氧气得到电子生成氢氧根离子,负极电极反应为H2+2OH﹣﹣2e﹣=2H2O,故答案为:氧气;H2+2OH﹣﹣2e﹣=2H2O;(3)X、Y、Z三种元素可组成一种强酸W为HNO3 , C为NH3在适当条件下被W为HNO3溶液吸收生成一种盐为NH4NO3 , 溶液中铵根离子水解溶液显酸性,溶液PH<7,水解反应的离子方程式为:NH4++H2ONH3H2O+H+ , 溶液中所有离子浓度大小顺序为c(NO3﹣)>c(NH4+)>c(H+)>c(OH﹣),故答案为:小于;NH4++H2ONH3H2O+H+;c(NO3﹣)>c(NH4+)>c(H+)>c(OH﹣);(4)实验室制取C为氨气的化学方程式为氢氧化钙和氯化铵加热反应生成氯化钙、氨气和水,反应的化学方程式为2NH4Cl+Ca(OH)2 ![]() CaCl2+2H2O+2NH3↑,故答案为:2NH4Cl+Ca(OH)2
CaCl2+2H2O+2NH3↑,故答案为:2NH4Cl+Ca(OH)2 ![]() CaCl2+2H2O+2NH3↑. 短周期中形成无色气体单质的只有H2、N2、O2(稀有气体除外),三元素的质子数之和为16,三种单质相互化合可以得到NO、H2O、NH3 , 且一个B分子中含有的Z原子个数比C分子中少1个,则B为H2O、C为NH3、Z为氢,由转化关系可知,故A为NO,X为氧,Y为氮,据此解答,(1)Y为氮元素是7号元素,位于周期表中第二周期VA族;(2)X的单质为氧气与Z的单质为氢气,形成原电池反应负极上是氢气失电子发生氧化反应在碱溶液中生成水,正极是氧气得到电子生成氢氧根离子;(3)X、Y、Z三种元素可组成一种强酸W为HNO3 , C为NH3在适当条件下被W为HNO3溶液吸收生成一种盐为NH4NO3 , 溶液中铵根离子水解溶液显酸性;(4)实验室制取C为氨气的化学方程式为氢氧化钙和氯化铵加热反应生成氯化钙、氨气和水.
CaCl2+2H2O+2NH3↑. 短周期中形成无色气体单质的只有H2、N2、O2(稀有气体除外),三元素的质子数之和为16,三种单质相互化合可以得到NO、H2O、NH3 , 且一个B分子中含有的Z原子个数比C分子中少1个,则B为H2O、C为NH3、Z为氢,由转化关系可知,故A为NO,X为氧,Y为氮,据此解答,(1)Y为氮元素是7号元素,位于周期表中第二周期VA族;(2)X的单质为氧气与Z的单质为氢气,形成原电池反应负极上是氢气失电子发生氧化反应在碱溶液中生成水,正极是氧气得到电子生成氢氧根离子;(3)X、Y、Z三种元素可组成一种强酸W为HNO3 , C为NH3在适当条件下被W为HNO3溶液吸收生成一种盐为NH4NO3 , 溶液中铵根离子水解溶液显酸性;(4)实验室制取C为氨气的化学方程式为氢氧化钙和氯化铵加热反应生成氯化钙、氨气和水.