题目内容
【题目】巴伊亚祖母绿号称是世界上最大的祖母绿矿石,重380余公斤,含有约18万克拉的祖母绿宝石,价值约4亿美元。祖母绿的元素组成是O、Si、Al、Be,化学式为Be3Al2Si6O18 。
(1)基态Al原子中,电子占据的最高能级的符号是 ,该能级具有的原子轨道数为 。
(2)在500~600℃气相中,氯化铍以二聚体Be2Cl4的形式存在(如图),在1000℃,氯化铍则以BeCl2形式存在。在BeCl2分子中,Be的杂化方式为 ,二聚体Be2Cl4中Be的杂化方式为 ,1mol Be2Cl4中含有 mol配位键。

(3)氢化铝锂(LiAlH4)是有机合成中的一种重要还原剂,可以将羧基还原为羟基,如可将乙酸还原为乙醇,乙酸和乙醇的熔沸点数据如下:
乙酸 | 乙醇 | |
熔点/℃ | 16.6 | -114.3 |
沸点/℃ | 117.9 | 78.4 |
乙酸分子中σ键与π键数目之比为 ,由表格中的数据知,乙酸的熔沸点均比乙醇高,原因是 。
(4)图示为Be与O形成的氧化物的立方晶胞结构,已知氧化铍的密度ρ=3.00g/cm3,则晶胞参数a= nm。

【答案】(1)3p,3(2)sp,sp2,2(3)7:1 乙酸中羧基上的两个氧原子均可形成氢键,比乙醇形成分子间氢键的概率大。(4)0.38
【解析】试题分析:(1)基态Al原子的质子数是13,核外电子排布式为1s22s2p63s23p1,所以电子占据的最高能级的符号是3p,该能级具有的原子轨道数为3个。
(2)BeCl2中Be原子的价层电子对个数=2+(2-2×1)/2=2,不含孤电子对,则分子空间构型是直线型,因此Be的杂化方式为sp杂化。在二聚体中Be原子形成3个B-Cl键,没有孤对电子,杂化轨道数目为3,Be原子杂化方式为sp2,根据结构式可判断1mol Be2Cl4中含有2mol配位键;
(3)单键都是σ键,双键中含有1个σ键和1个π键,则根据乙酸的结构简式CH3COOOH可知乙酸分子中σ键与π键数目之比为7:1;由于乙酸中羧基上的两个氧原子均可形成氢键,比乙醇形成分子间氢键的概率大,因此乙酸的熔沸点均比乙醇高。
(4)根据晶胞结构可知该晶胞中含有的阴阳离子个数均是4个,所以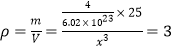 ,解得x=0.38×10-7cm=0.38nm。
,解得x=0.38×10-7cm=0.38nm。

【题目】五种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水。
阳离子 | Na+ | Al3+ | Fe3+ | Cu2+ | Ba2+ |
阴离子 | OH- | Cl- | CO32- | NO3- | SO42- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4 g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6 mol/L稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断A的化学式为:A ;
(2)写出步骤②中发生反应的离子方程式 。
(3)D溶液中滴入石蕊试液,现象是 ,原因是 (用离子方程式说明)。
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是 mL。

