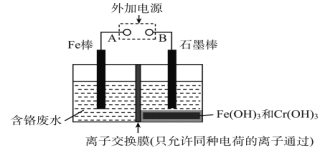
��Ŀ����
����Ŀ�������Ƶ��ܱ���������м���һ���������İ�������粒���(��������������䣬��������������Բ���)���ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4(s)![]() 2NH3(g)��CO2(g) ��H>0������˵������ȷ����
2NH3(g)��CO2(g) ��H>0������˵������ȷ����
A. �ܱ������������ƽ����Է�������������÷�Ӧ�ﵽƽ��״̬
B. �÷�Ӧ���κ������¶����Է�����
C. �ټ���һ������������泥��ɼӿ췴Ӧ����
D. �����¶Ȳ��䣬ѹ�������NH3��Ũ�Ȳ���ʱ���ʹﵽ���µ�ƽ��
���𰸡�D
��������
���ɵ���������ʵ���֮��ʼ����2��1�������ƽ����Է�������ʼ�ղ��䣻����H-T��S<0�����Է����У��ı�������ʵ����Ի�ѧ��Ӧ����û��Ӱ�죻������ѹ�������ƽ�������ƶ�������ϵ��������������ʵ���֮��ʼ�ղ��䣬����������������䡣
��ӦNH2COONH4��s���T2NH3��g��+CO2��g�������ɵ���������ʵ���֮��ʼ����2��1�����������ƽ����Է�������ʼ�ղ��䣬�ʲ�����Ϊƽ��״̬���ж����ݣ���A���÷�Ӧ��H>0����S>0�����������£�H-T��S<0�������Է����У�B���������ʵĶ��ٶԻ�ѧ��Ӧ����û��Ӱ�죬C��������ѹ�������ƽ�������ƶ�������ϵ��������������ʵ���֮��ʼ�ղ��䣬������������������䣬D����

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��ij�¶�ʱ����һ��2L���ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�����ݣ�����д���пհף�
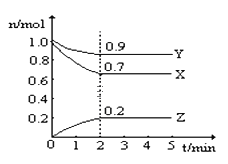
��1���÷�Ӧ�Ļ�ѧ����ʽΪ _______________________��
��2���ӿ�ʼ��2min��Z��ƽ����Ӧ����Ϊ ___________��
��3��ij̽����ѧϰС������ͬ������п����ͬŨ�ȵ�������ϡ���ᷴӦ�õ�ʵ���������±���ʾ��
ʵ���� | п��״̬ | ��Ӧ�¶�/�� | �ռ�100mL��������ʱ��/s |
�� | ��Ƭ | 15 | 200 |
�� | ��Ƭ | 25 | 90 |
�� | ��ĩ | 25 | 10 |
�ٸ�ʵ���Ŀ����̽�� ______ �� ______ ��п��ϡ���ᷴӦ���ʵ�Ӱ�죻
��ʵ���͢���� ________________________________ ����ѧ��Ӧ����Խ��
���ܱ�������ı�����Է�Ӧ������Ӱ���ʵ������ ______ �� ______��
�������һ��ʵ�鷽��֤�������Ũ�ȶԸ÷�Ӧ�����ʵ�Ӱ�죺 ______________________��
����Ŀ���о�CO2�����öԴٽ���̼���Ĺ���������Ҫ�����塣
I����֪ijЩ��ѧ���ļ�����������
��ѧ�� | C=O | C��O | C��H | H��H | O��H |
����/kJ��mol-1 | 745 | 351 | 415 | 436 | 462 |
��CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ��H = __________ kJ��mol-1
CH3OH(g) + H2O(g) ��H = __________ kJ��mol-1
II����ȼú�����е�CO2ת��Ϊ�����ѵķ�Ӧԭ��Ϊ��2CO2(g) + 6H2(g)![]() CH3OCH3(g) + 3H2O(l)
CH3OCH3(g) + 3H2O(l)
��1���÷�Ӧ��ѧƽ�ⳣ������ʽK = __________��
��2����֪��ijѹǿ�£��÷�Ӧ�ڲ�ͬ�¶ȡ���ͬͶ�ϱ�ʱ����ƽ��ʱCO2��ת������ͼ��ʾ��

�ٸ÷�Ӧ�Ħ�H __________ 0���>"��<������
�����¶Ȳ��䣬��С��ӦͶ�ϱ�[n(H2)/n(CO2)]��Kֵ��____������������������С����������������
��3��ij�¶��£������һ�����ܱ�������ͨ��CO2(g)��H2(g)����������Ӧ���������������ٷ����仯ʱ����˵����Ӧ�ﵽƽ��״̬����__________��
A��������̼��Ũ�� B�������е�ѹǿ
C��������ܶ� D��CH3OCH3��H2O�����ʵ���֮��
��4��ij�¶��£�������ɱ���ܱ������У��ı���ʼʱ��������ʵ������ڲ�ͬ��ѹǿ�£�ƽ��ʱCH3OCH3(g)�����ʵ������±���ʾ��
P1 | P2 | P3 | |
I��2.0 mol CO2 6.0 mol H2 | 0.10 mol | 0.04 mol | 0.02 mol |
II��1.0 mol CO22 | X1 | Y1 | Z1 |
III��1.0 mol CH3OCH3 3.0 mol H2O | X2 | Y2 | Z2 |
��P1 __________ P3���>����<����=������
��P2�£�III��CH3OCH3��ƽ��ת����Ϊ__________��