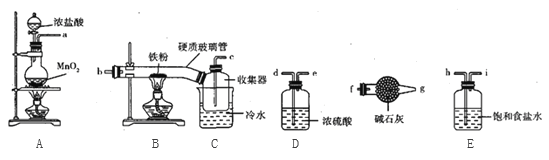
题目内容
【题目】为比较Fe3+和Cu2+对H2O2分解反应的催化效果,甲、乙两位同学分别设计了如图甲、乙所示的实验。下列叙述中不正确的是
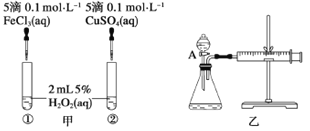
A. 图甲所示实验可通过观察产生气泡的快慢来比较反应速率的大小
B. 若图甲实验中反应速率为①>②,则一定说明Fe3+比Cu2+对H2O2分解催化效果好
C. 用图乙所示装置测定反应速率,可测定反应产生的气体体积及反应时间
D. 为检查图乙所示装置的气密性,可关闭A处活塞。将注射器活塞拉出一定距离,一段时间后松开活塞,观察活塞是否回到原位
【答案】B
【解析】
试题A.反应的剧烈程度与实验现象有关,反应越剧烈,产生气体的速率越快,产生气泡越快,所以正确;B.催化剂能改变化学反应的速率,这里是加快速率,若图1所示实验中反应速率为①>②,则一定说明氯化铁比硫酸铜催化效果好,因二者所含的阴离子不同,要证明Fe3+比Cu2+对H2O2分解催化效果好,还要使选择的试剂中阴离子种类相同,错误.C.反应速率可用单位时间内产生的气体体积表示,该装置可通过注射器活塞的位置变化看生成气体的体积,正确.D.检查装置的气密性一般是利用气压的原理,在图2装置中,关闭A处活塞,将注射器的活塞拉出一定距离,过一段时间后再松开活塞,如活塞回到原位,说明气密性良好,否则漏气,正确。

【题目】臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是______________和________________(填分子式)。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216 mol/L。
T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
①pH增大能加速O3分解,表明对O3分解起催化作用的是________。
②在30 ℃、pH=4.0条件下,O3的分解速率为________mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填字母代号)。
a.40 ℃、pH=3.0
b.10 ℃、pH=4.0
c.30 ℃、pH=7.0