��Ŀ����
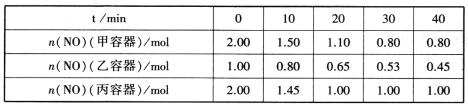
����Ŀ��ij�¶�ʱ����һ��2L���ܱ������У�X��Y��Z�������ʵ����ʵ�����ʱ��ı仯������ͼ��ʾ������ͼ�����ݣ�����д���пհף�
��1���÷�Ӧ�Ļ�ѧ����ʽΪ _______________________��
��2���ӿ�ʼ��2min��Z��ƽ����Ӧ����Ϊ ___________��
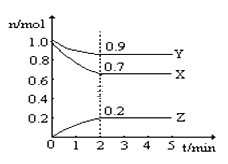
��3��ij̽����ѧϰС������ͬ������п����ͬŨ�ȵ�������ϡ���ᷴӦ�õ�ʵ���������±���ʾ��
ʵ���� | п��״̬ | ��Ӧ�¶�/�� | �ռ�100mL��������ʱ��/s |
�� | ��Ƭ | 15 | 200 |
�� | ��Ƭ | 25 | 90 |
�� | ��ĩ | 25 | 10 |
�ٸ�ʵ���Ŀ����̽�� ______ �� ______ ��п��ϡ���ᷴӦ���ʵ�Ӱ�죻
��ʵ���͢���� ________________________________ ����ѧ��Ӧ����Խ��
���ܱ�������ı�����Է�Ӧ������Ӱ���ʵ������ ______ �� ______��
�������һ��ʵ�鷽��֤�������Ũ�ȶԸ÷�Ӧ�����ʵ�Ӱ�죺 ______________________��
���𰸡�3X+Y2Z 0.05mol/��Lmin�� �������� �¶� �¶�Խ�� �� �� ����ͬ���¶��£�������ͬ״̬��������ͬ��пƬ�����������ͬ��Ũ�Ȳ�ͬ�����ᷴӦ
��������
��ͼ��֪��Y��X�����ʵ�����С��Z�����ʵ������ӣ���Y��XΪ��Ӧ�ZΪ�����2min�ﵽƽ��״̬���ɷ�Ӧ����֮�ȵ��ڻ�ѧ������֮���жϣ����ݷ�Ӧ���ʵĺ������������Է�Ӧ���ʵ�Ӱ��仯�������ÿ��Ʊ������������
��1����ͼ��֪��Y��X�����ʵ�����С��Z�����ʵ������ӣ���Y��XΪ��Ӧ�ZΪ�����Y��X��Z�ġ�n֮��Ϊ(1��0.9):(1��0.7):(0.2��0)=1:3:2��2min�ﵽƽ��״̬���ɷ�Ӧ����֮�ȵ��ڻ�ѧ������֮�ȿ�֪����Ӧ����ʽΪΪ3X(g)+Y(g)2Z(g)��
��2���ӿ�ʼ��2min��Z��ƽ����Ӧ����Ϊ0.2mol/(2L��2min)=0.05molL��1��min1��
��3�����ɱ����е����ݿ���֪��,п��״̬��ͬ���¶Ȳ�ͬ����ʵ��Ŀ��Ϊ̽���Ӵ�������¶ȶ�п��ϡ���ᷴӦ���ʵ�Ӱ�죻
��ʵ���͢����¶Ȳ�ͬ������������ͬ���¶ȴ�ķ�Ӧ���ʿ죬���¶�Խ�ߣ���Ӧ����Խ�죻
���ܱ�������ı�����Է�Ӧ������Ӱ�죬Ӧ�����¶���ͬ����ӦΪ��͢���ʵ�飻
��Ҫ֤�������Ũ�ȶԸ÷�Ӧ�����ʵ�Ӱ��ѡ�ÿ�������������ͬ����ʵ�鷽��Ϊ����ͬ���¶��£�������ͬ״̬��������ͬ��пƬ�����������ͬ��Ũ�Ȳ�ͬ�����ᷴӦ��

 �ŵ������ϵ�д�
�ŵ������ϵ�д� 53������ϵ�д�
53������ϵ�д�