题目内容
【题目】下列示意图与对应的反应情况正确的是
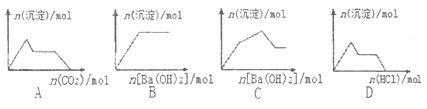
A. 含0.01molKOH和0.01molCa(OH)2的混合溶液中缓慢通入CO2
B. NaHSO4溶液中逐滴加入Ba(OH)2溶液
C. KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
D. Na[Al(OH)4]溶液中逐滴加入盐酸
【答案】B
【解析】A、CO2先与Ca(OH)2反应生成CaCO3沉淀,然后CO2与NaOH反应生成Na2CO3,此时沉淀还不会溶解减少,接下来CO2继续与Na2CO3反应生成NaHCO3,最后CO2与CaCO3反应,沉淀溶解直至完全消失,A错误。B 、NaHSO4溶液中逐滴加入Ba(OH)2溶液,Ba2+与SO42-一开始就生成BaSO4沉淀,至SO42-完全沉淀,沉淀的量不再变化,B正确。C、设KAl(SO4)2有1mol,则含有1molAl3+和2molSO42-,1molAl3+完全沉淀时消耗1.5mol Ba(OH)2,生成1molAl(OH)3沉淀,同时生成1.5molBaSO4沉淀,仍有0.5molSO42-未沉淀,此时沉淀的物质的量总共为2.5mol。再继续滴加Ba(OH)2时,设再滴加xmol Ba(OH)2,则继续生成xmolBaSO4沉淀,而将会溶解2xmol Al(OH)3沉淀,所以沉淀减少的物质的量大于生成的沉淀的物质的量,故总的沉淀的物质的量将减少,而不会再增加,因此,当沉淀的物质的量达到最大值时,再加Ba(OH)2,沉淀的物质的量是减小的,即沉淀的物质的量增加的曲线只有一段而不是两段,故C错误。D、Na[Al(OH)4]即NaAlO2,加入稀盐酸,AlO2-与H +先生成沉淀达到最大值,然后沉淀逐渐溶解至完全消失,D错误。正确答案为B。
点睛 :理解在复杂的体系中,确认化学反应先后顺序有利于解决问题。在复杂的非氧化还原反应体系中,先考虑酸(CO2相当于酸、H+)与碱(OH-)中和反应, 后考虑酸与盐之间或碱与盐之间的反应;在含有沉淀的悬浊液中滴加溶液或通入气体时,先考虑和体系中可溶的溶质反应,后考虑和体系中固体的反应;若是生成沉淀反应体系,则沉淀的溶度积或溶解度越小越容易发生反应生成沉淀;这些均符合强者优先反应的原则,谁强势谁胜利,谁强谁先反应。

 53随堂测系列答案
53随堂测系列答案