题目内容
【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血的特效药。下面是以商品级纯度铁屑(含少量锡等杂质)生产绿矾的一种方法:
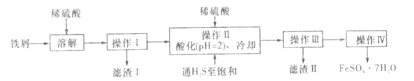
已知:在H2S饱和溶液中,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5.
(1)用KSCN检验绿矾晶体中是否含有Fe3+的离子方程式为:______________________。
(2)检验所得绿矾晶体中是否含有Fe3+的实验操作是_________。
(3)操作Ⅱ在溶液中用硫酸酸化至pH=2的目的是_________;通入硫化氢至饱和的目的是:
①除去操作I所得溶液中含有的Sn2+等杂质离子;
②______________________________。
(4)操作IV的顺序依次为:__________。
(5)操作IV得到的绿矾晶体需要洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②降低洗涤过程中FeSO4·7H2O的损耗。洗涤晶体的溶液可以是_____(填正确选项序号)。
a.冰水 b.饱和Na2SO4溶液 c.乙醇
(6)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL(滴定时KMnO4溶液只与Fe2+发生反应)。
①计算上述样品中FeSO4·7H2O的质量分数为______(保留4位有效数字);
②若用上述方法测定的样品中FeSO4·7H2O的质量分数偏低(测定过程中产生的误差可忽略),其可能原因有_____________。
【答案】 Fe3++3SCN—= Fe(SCN)3 取少量绿矾晶体溶于水,充分搅拌,向溶液中滴加几滴KSCN溶液,如果溶液显红色,则绿矾中含Fe3+,反之不含Fe3+。 使Sn2+完全变成SnS沉淀,而Fe2+不沉淀 防止Fe2+氧化 蒸发浓缩、冷却结晶、过滤(洗涤) ac 97.54% 样品中存在少量的杂质(如H2O、H2SO4等)或样品部分被氧化
【解析】本题属于工艺流程题,以一种无机物的制备为载体,综合考查实验操作、实验设计、分离提纯、利用滴定法测定溶液浓度、离子的检验方法及有关计算等化学中常见的考点。
Fe、Sn在稀硫酸的作用下反应生成Fe2+和Sn2+,过滤除去不溶杂质,在pH=2的酸性环境中通入H2S气体,Sn2+转化为SnS沉淀过滤而与Fe2+分离,最后得到FeSO4溶液,经过一系列操作后即可得到绿矾。
(1)向溶液中加入几滴无色KSCN溶液,如果溶液显红色,则溶液中含Fe3+,如果无明显现象则不含Fe3+,这是因为Fe3+能与SCNˉ结合生成一种红色的物质Fe(SCN)3,发生的离子方程式为Fe3++3SCN-=Fe(SCN)3
(2)检验Fe3+的实验操作是:取少量绿矾晶体溶于水,充分搅拌,向溶液中滴加几滴KSCN溶液,如果溶液显红色,则绿矾中含Fe3+,反之不含Fe3+。
(3))操作Ⅱ中用硫酸酸化至溶液pH=2时,根据已知信息可知Sn2+完全变成SnS沉淀,而Fe2+不会沉淀,故加入硫酸的目的是:使Sn2+完全变成SnS沉淀,而Fe2+不沉淀;通入的H2S除了能将Sn2+转化为SnS沉淀而除去外,还因为Fe2+易被氧化为Fe3+,H2S具有还原性,能将氧化生成的Fe3+又还原为Fe2+ ,从而防止了Fe2+的氧化,故另外一个目的是:防止Fe2+氧化。
(4)经过操作Ⅲ后,得到较纯净的FeSO4溶液,然后将稀的溶液蒸发浓缩得到浓度较高的溶液、再将温度较高的溶液降温,溶解度减小从而析出晶体,然后过滤,将沉淀洗涤就得到绿矾,故答案为:蒸发浓缩、冷却结晶、过滤(洗涤)
(5)为了得到纯净的绿矾晶体,需要除去晶体表面的H2SO4杂质,并且降低在洗涤过程中FeSO4·7H2O的损耗。硫酸可溶于水,冰水的温度低,绿矾的溶解变小,故可降低绿矾的损耗,冰水符合答案;硫酸可溶于饱和Na2SO4溶液,但不能降低绿矾的溶解度,所以饱和Na2SO4溶液不符合答案;硫酸溶于乙醇,绿矾不溶于乙醇,而且乙醇易挥发,故可除去硫酸又可降低绿矾的损耗,乙醇符合题目要求,答案选ac。
(6)①Fe2+与酸性高锰酸钾溶液反应的离子方程式为:5Fe2++MnO4-+8H+= 5Fe3++Mn2 + + 4H2O,总共消耗的KMnO4的物质的量为0.01×20×10-3×10mol=2×10-3mol,根据以上方程式可知Fe2+的物质的量为5×2×10-3mol=0.01mol,即FeSO4·7H2O的物质的量也为0.01mol,质量为0.01×278g=2.78g,故样品中FeSO4·7H2O的质量分数为(2.78/2.85)×100%=97.54%
②若样品中含有杂质(如H2O或H2SO4),则实际含有的Fe2+ 的含量偏低,消耗的KMnO4的体积偏少,所测的结果偏低;若样品中所含有的Fe2+已经部分被氧化,则实际含有的Fe2+含量也偏小,导致消耗的KMnO4的体积偏少,所测结果偏低;故本题的答案为:样品中存在少量的杂质(如H2O、H2SO4等)或样品部分被氧化。