题目内容
【题目】已知A、B、C、D和E是原子序数依次增大前20号元素。A原子价电子层p轨道中只有1个电子;B、C、D元素的基态原子具有相同的能层数,B、D元素原子的p能级上都有1个未成对电子,D原子得一个电子填入3p轨道后,3p轨道已充满,C原子的p轨道中有3个未成对电子;E是同周期第一电离能最小的元素。回答下列问题:
(1)A的元素符号为 ___________、 B3+的结构示意图为___________、C的最高价氧化物对应水化物为____________;E的价电子排布式为______________。
(2)上述五种元素中最高价氧化物对应水化物酸性最强的是___________,(填写化学式)碱性最强物质的电子式为_____________; D所在周期(除稀有气体元素外)第一电离能最小的元素是_________;在AD3分子中A元素原子的杂化方式是__________,分子空间构型为_______________;
(3)准晶是一种无平移周期序但有严格准周期位置序的独特晶体,可通过____________方法区分晶体、准晶体和非晶体。
(4)C单质为面心立方晶体,其晶胞参数a=0.405nm,晶胞中铝原子的配位数为_____,列式表示Al单质的密度____________________g·cm﹣3(不必计算出结果)。
(5)石墨具有平面层状结构,同一层中的原子构成许许多多的正六边形,它与熔融的E单质相互作用,形成某种青铜色的物质(其中的元素E用“●”表示),原子分布如图所示,该物质的化学式为_______________。

【答案】 B ![]() H3PO4 4s1 HClO4
H3PO4 4s1 HClO4 ![]() Na sp2 平面三角形 X射线衍射 12
Na sp2 平面三角形 X射线衍射 12 ![]() KC8
KC8
【解析】A、B、C、D和E都是元素周期表中前20号的元素,它们的原子序数依次增大,B、C、D元素的基态原子具有相同的能层数,处于同一周期,B、D元素的原子的p能级上都有1个未成对电子,价层电子排布为ns2np1或ns2np5,D原子得一个电子填入3p轨道后,3p轨道已充满,故D为Cl元素,B为Al元素,C原子的p轨道中有3个未成对电子,价层电子排布为3s23p3,故C为P元素;E是同周期第一电离能最小的元素,处于第ⅠA族,原子序数最大,故E处于第四周期,为K元素,A原子的价电子层的p轨道中只有1个电子,价层电子排布为ns2np1,处于第ⅢA族,原子序数最小,故A为B元素。
(1)由上述分析可知,A为B元素,B为Al元素,Al3+的结构示意图为![]() ,C为P元素,最高价氧化物对应水化物为H3PO4,E为K元素,价电子排布式为4s1,故答案为:B;
,C为P元素,最高价氧化物对应水化物为H3PO4,E为K元素,价电子排布式为4s1,故答案为:B;![]() ;H3PO4;4s1;
;H3PO4;4s1;
(2)五种元素中Cl元素非金属性最强,最高价氧化物对应水化物酸性最强的是HClO4,K元素的金属性最强,故KOH碱性最强,电子式为![]() ,D为Cl元素,所在周期为第三周期,同周期自左而右,第一电离能增大,故第三周期中第一电离能最小的元素是Na;在BCl3分子中B原子与3个氯原子相连,没有孤对电子,杂化轨道数目为3,采用sp2杂化,空间构型为平面三角形,故答案为:HClO4,
,D为Cl元素,所在周期为第三周期,同周期自左而右,第一电离能增大,故第三周期中第一电离能最小的元素是Na;在BCl3分子中B原子与3个氯原子相连,没有孤对电子,杂化轨道数目为3,采用sp2杂化,空间构型为平面三角形,故答案为:HClO4,![]() ;sp2;平面三角形;
;sp2;平面三角形;
(3)准晶是一种无平移周期序但有严格准周期位置序的独特晶体,可通过X射线衍射方法区分晶体、准晶体和非晶体,故答案为:X射线衍射;
(4)Al单质为面心立方晶体,铝原子个数8×![]() +6×
+6×![]() =4,晶胞中铝原子的配位数为3×8÷2=12,Al单质的密度=
=4,晶胞中铝原子的配位数为3×8÷2=12,Al单质的密度=![]() =
=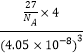 gcm-3=
gcm-3=![]() gcm-3,故答案为:12;
gcm-3,故答案为:12;![]() 。
。
(5)如图所示,K原子镶嵌在正六边形的中心,该正六边形周围有6个未镶嵌K原子的C原子正六边形结构,即每正六边形周围连接6个C原子,该碳原子为3个正六边形共有,故结构中K原子与C原子数目之比为1:(6+6×![]() )=8,故化学式为KC8,故答案为:KC8。
)=8,故化学式为KC8,故答案为:KC8。

【题目】下列物质中杂质(括号内为杂质)的除杂试剂和除杂方法都正确的是
物质及其杂质 | 除杂试剂 | 除杂方法 | |
A | CO2(SO2) | 饱和碳酸钠溶液 | 洗气 |
B | NH4Cl(I2) | 无 | 加热 |
C | Cl2 (HCl) | NaOH溶液 | 洗气 |
D | FeCl2(FeCl3) | 过量Fe粉 | 过滤 |
A. A B. B C. C D. D