题目内容
【题目】为实现 “节能减排” 和“低碳经济”的一项课题是如何将CO2转化为可利用资源。
(1)25℃,1.01×105Pa时,32g液态甲醇(CH3OH)完全燃烧,当恢复到原状态时,放出热量726.6KJ,该反应的热化学方程式为______________________________________________。
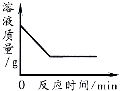
(2)目前,工业上常用CO2来生产燃料甲醇。现进行如下实验:在体积为l L的密闭恒容容器中,充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) ΔH=-49.0 kJ/mol。测得CO2和CH3OH(g)的浓度随时间变化如图所示。

①从反应开始到平衡时,CH3OH的平均反应速率v(CH3OH)=_______________(注明单位);
②用三段式计算H2的转化率____________;
③下列说法中,能说明上述反应达到平衡状态的是_____
A.每消耗1mol CO2的同时生成1mol CH3OH
B. CO2、H2、CH3OH和H2O的物质的量的比为1:3:1:1
C. 容器中气体的压强不再改变
D. 容器中气体的密度不再改变
④下列措施中,能使上述平衡状态向正反应方向移动的是______
A.升高温度 B.将CH3OH(g)从体系中分离
C.使用高效催化剂 D.恒温恒容再充入1 molCO2和3 mol H2
【答案】 CH3OH(l)+![]() O 2(g)=CO2(g)+2H2O(l) △H=-726.6KJ/mol 0.075 mol·(L·min)-1 H2的转化率=2.25/3.0×100% =75% C BD
O 2(g)=CO2(g)+2H2O(l) △H=-726.6KJ/mol 0.075 mol·(L·min)-1 H2的转化率=2.25/3.0×100% =75% C BD
【解析】(1)32g液态甲醇(CH3OH)的物质的量为32g/32g/mol=1mol,)25℃,1.01×105Pa时,水为液态,则反应的热化学方程式为:CH3OH(l)+3/2O 2(g)=CO2(g)+2H2O(l) △H=-726.6KJ/mol;
(2)①根据图象可知生成CH3OH的浓度为0.75mol/L,所以v=△C/ t=0.75mol/L/10min==0.075mol/(Lmin);
②参加反应的二氧化碳的物质的量为0.75mol/L×1L=0.75mol,根据化学方程式可知,参加反应的氢气的物质的量为0.75mol×3=2.25mol,转化率=2.25mol/3mol×100%===75%;
③A.消耗CO2的同时生成CH3OH,都是指的正反应,不能反映出正逆反应速率的关系,故不能说明反应是否处于平衡状态;B.CO2、H2、CH3OH和H2O的物质的量的比与起始加入的量有关与反应是否处于平衡状态无关,故不能说明反应是否处于平衡状态;C.该反应为气体体积减小的反应,即压强也减小的反应,所以当容器中气体的压强不再改变时,就说明反应已经处于平衡状态;D.该反应容器体积不变,反应前后气体质量守恒,所以容器中气体的密度始终不变,所以不能根据密度的变化判断反应是否处于平衡状态;故选C;
④A.该反应为放热反应,升高温度平衡逆向移动,故A错误;B.将CH3OH(g)从体系中分离,即减小生成物浓度,平衡正向移动,故B正确;C.使用高效催化剂对平衡移动没有影响,所以平衡不移动,故C错误; D.恒温恒容再充入1molCO2和3molH2,相当于加压,由于反应是气体体积减小的反应,所以平衡正向移动,故D正确;故选BD;