题目内容
【题目】a~n10中元素在周期表中的位置如图所示,请回答下列问题:
a | ||||||||
b | c | d | e | |||||
f | g | h | m | n | ||||
…… |
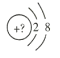
(1)m的阴离子的结构示意图为___。
(2)b的最高价氧化物的化学式为___;用化学方程式表示f、d的单质形成f2d2的过程___。
(3)d、g、n形成的简单离子的半径由大到小的顺序为___(用离子符号表示)。
(4)以上元素组成的物质有下列框图中的转化关系,其中甲为10电子微粒。
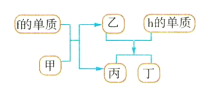
请写出h的单质与乙反应的化学方程式:___。
【答案】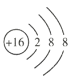 CO2 2Na+O2
CO2 2Na+O2![]() Na2O2 Cl->O2->Mg2+ 2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
Na2O2 Cl->O2->Mg2+ 2Al+2NaOH+6H2O=2Na[Al(OH)4]+3H2↑
【解析】
根据a~n这10种元素在周期表中的位置可判断,它们分别是H、C、N、O、Ne、Na、Mg、Al、S、Cl,
(1)S2-的核电荷数为16,核外电子数为18,故其结构示意图为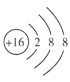 ;
;
(2)b为C,其最高价氧化物是CO2;Na在空气中受热生成Na2O2,其化学方程式为:2Na+O2![]() Na2O2;
Na2O2;
(3)核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,Cl-核外有3个电子层,Mg2+与O2-核外有2个电子层,且二者电子层结构相同,则d、g、n形成的简单离子的半径由大到小的顺序为![]() ;
;
(4)常见10电子微粒有CH4、NH3、H2O、HF等,f为Na,h为Al,Na与某10电子微粒反应的产物能与Al反应,则甲为H2O,则乙为NaOH,丙为H2,Al与NaOH反应生成![]() 和H2,丁是
和H2,丁是![]() ,Al与NaOH反应的化学方程式为:
,Al与NaOH反应的化学方程式为:![]() 。
。

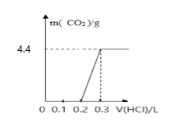
【题目】对于反应:![]() ,当其他条件不变,只改变一个反应条件时,将生成SO3的速率的变化填入表格(填写“增大”“减小”或“不变”)。
,当其他条件不变,只改变一个反应条件时,将生成SO3的速率的变化填入表格(填写“增大”“减小”或“不变”)。
编号 | 改变的条件 | 生成SO3的速率 |
① | 升高温度 | _______ |
② | 降低温度 | _______ |
③ | 增大O2的浓度 | _______ |
④ | 使用V2O5作催化剂 | _______ |
【题目】某温度下,H2(g)+CO2(g)![]() H2O(g)+CO2(g)的平衡常数
H2O(g)+CO2(g)的平衡常数![]() 。该温度下在甲、乙、丙三个恒容密闭容器中,
。该温度下在甲、乙、丙三个恒容密闭容器中,
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/mol | 0.010 | 0.020 | 0.020 |
c(CO2)/mol | 0.010 | 0.010 | 0.020 |
投入H2(g)和CO2(g),其起始浓度如表所示。下列判断不正确的是( )
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢