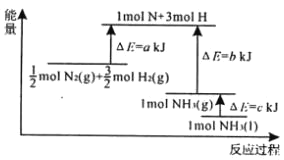
题目内容
【题目】将一定量的CO2气体通入500 mL某氢氧化钠溶液中,充分反应后将溶液在低温下蒸发,得到不含结晶水的白色固体A,取三份质量不相同的A试样分别与50mL相同浓度的盐酸溶液反应,得到标准状况下气体体积与固体A的质量关系如表所示:
组别 | ① | ② | ③ |
A的质量 | 3.80 | 5.70 | 7.60 |
气体体积(mL) | 896 | 1344 | 1120 |
(1)试判断:A的成分___。
(2)盐酸物质的量浓度为___molL﹣1。
【答案】NaHCO3和Na2CO3 1.8
【解析】
(1)根据第①组数据,用讨论的方法判断物质的成分;
(2)②、③组可说明盐酸完全反应,根据第2组结合元素质量守恒计算。
(1)由②的数据可知,①组中白色固体反应完全,①组反应生成的CO2为:n(CO2)=![]() =0.04mol,
=0.04mol,
若A全为Na2CO3,生成的CO2为:n(CO2)=![]() =0.036mol<0.04mol,
=0.036mol<0.04mol,
若A全为NaHCO3,生成的CO2为:n(CO2)=![]() =0.045mol>0.04mol,由上可知,A应为NaHCO3和Na2CO3的混合物;
=0.045mol>0.04mol,由上可知,A应为NaHCO3和Na2CO3的混合物;
(2)由第②组可知,盐酸和A完全反应,设混合物中含有xmolNa2CO3,ymolNaHCO3,
则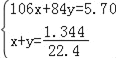 ,解之得:
,解之得: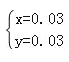 ;
;
根据元素守恒可知:n(HCl)=n(Na+)=2×n(Na2CO3)+n(NaHCO3)=2×0.03mol+0.03mol=0.09mol,
c(HCl)=![]() =1.8mol/L。
=1.8mol/L。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=11,AgNO3溶液pH=5,二者水解的离子分别是 。
(2)调节pH,实验记录如下:
实验 | pH | 现象 |
A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
Ⅰ.Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
Ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应
①推测a中白色沉淀为Ag2SO3,离子方程式是 。
②推测a中白色沉淀为Ag2SO4,推测的依据是 。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4,实验方法是:另取Ag2SO4固体置于 溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀
①实验Ⅰ的目的是 。
②根据实验现象,分析X的性质和元素组成是 。
③Ⅱ中反应的化学方程式是 。
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强,还原性增强。通过进一步实验确认了这种可能性,实验如图所示:
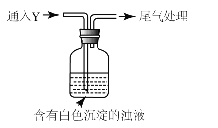
①气体Y是 。
②白色沉淀转化为X的化学方程式是 。