题目内容
【题目】200℃时,11.6g CO2和水蒸气的混合气体与过量的Na2O2充分反应后,固体质量增加了3.6g,再将反应后剩余固体冷却后加入含有Na+、HCO3-、SO32-、CO32-等离子的水溶液中,若溶液体积保持不变,则下列说法中正确的是
A.原混合气体的平均摩尔质量为23.2g/mol
B.混合气体与Na2O2反应过程中电子转移的物质的量为0.25mol
C.溶液中SO32-的物质的量浓度基本保持不变
D.溶液中HCO3-的物质的量浓度减小,CO32-的物质的量浓度增大,但是HCO3-和CO32-的物质的量浓度之和基本保持不变
【答案】A
【解析】
向足量的固体Na2O2中通入11.6gCO2和H2O,固体质量增加3.6g,是因为生成O2,根据质量守恒定律可知m(O2)=11.6g-3.6g=8.0g,所以n(O2)=![]() =0.25mol,设混合物中CO2和水蒸气的物质的量分别为xmol,ymol,则:
=0.25mol,设混合物中CO2和水蒸气的物质的量分别为xmol,ymol,则:
2Na2O2+2CO2=2Na2CO3+O2,
xmol 0.5xmol
2Na2O2+2H2O=4NaOH+O2↑
ymol 0.5ymol
所以0.5x+0.5y=0.25,44x+18y=11.6,解得:x=0.1,y=0.4。
A.原混合气体的平均摩尔质量=![]() =23.2g/mol,故A正确;
=23.2g/mol,故A正确;
B.反应中生成氧气为0.25mol,故转移电子为0.25mol×2=0.5mol,故B错误;
C.过氧化钠有剩余,可以氧化SO32-,溶液中SO32-的物质的量浓度减小,故C错误;
D.由于反应后固体中含有碳酸钠,溶液HCO3-和CO32-的物质的量浓度之和增大,故D错误;
答案选A。

【题目】将一定量的CO2气体通入500 mL某氢氧化钠溶液中,充分反应后将溶液在低温下蒸发,得到不含结晶水的白色固体A,取三份质量不相同的A试样分别与50mL相同浓度的盐酸溶液反应,得到标准状况下气体体积与固体A的质量关系如表所示:
组别 | ① | ② | ③ |
A的质量 | 3.80 | 5.70 | 7.60 |
气体体积(mL) | 896 | 1344 | 1120 |
(1)试判断:A的成分___。
(2)盐酸物质的量浓度为___molL﹣1。
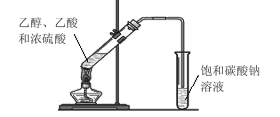
【题目】化学在生活中有着广泛的应用,下列对应关系错误的是
选项 | 化学性质 | 实际应用 |
A |
| 泡沫灭火器灭火 |
B |
| 可作面包的发泡剂 |
C | 乙酸具有酸性 | 常用于工业管道去除水垢 |
D | 次氯酸盐具有氧化性 | 漂白粉漂白织物 |
A.AB.B.C.CD.D