题目内容
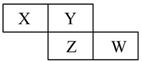
下表是元素周期表一部分,列出了十个元素在周期表中的位置:
请用化学用语回答下列问题
(1)在③~⑦元素中,原子半径最大的是 (填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是 (填物质化学式),呈两性的氢氧化物是 (填物质化学式);
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有 ;
(4)用电子式表示元素③与⑧形成化合物的过程 。
(5)写出含有32个电子的元素⑥的氢化物的分子式: 。
(6)写出工业冶炼⑤的化学方程式:
(7)写出将⑨元素单质从海水中(离子形式存在)提取所涉及到的三个步骤的离子方程式,第一步:Cl2+2Br-=2Cl-+Br2 第二步: ; 第三步Cl2+2Br-=2Cl-+Br2
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | | | | ⑥ | ⑦ | | | |
| 3 | ① | ③ | ⑤ | | | | ⑧ | ⑩ |
| 4 | ② | ④ | | | | | ⑨ | |
(1)在③~⑦元素中,原子半径最大的是 (填元素符号);
(2)①~⑩中元素最高价氧化物对应的水化物中酸性最强的是 (填物质化学式),呈两性的氢氧化物是 (填物质化学式);
(3)⑦元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型有 ;
(4)用电子式表示元素③与⑧形成化合物的过程 。
(5)写出含有32个电子的元素⑥的氢化物的分子式: 。
(6)写出工业冶炼⑤的化学方程式:
(7)写出将⑨元素单质从海水中(离子形式存在)提取所涉及到的三个步骤的离子方程式,第一步:Cl2+2Br-=2Cl-+Br2 第二步: ; 第三步Cl2+2Br-=2Cl-+Br2
(1)Ca
(2)HClO4、 Al(OH)3
(3)离子键、(极性)共价键
(4)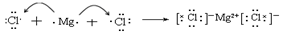
(5)C4H8
(6)2Al2O3 4Al +3O2↑ 冰晶石
4Al +3O2↑ 冰晶石
(7)Br2+ SO2 +2H2O=4H+ + SO42- + 2Br-
(2)HClO4、 Al(OH)3
(3)离子键、(极性)共价键
(4)
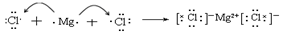
(5)C4H8
(6)2Al2O3
 4Al +3O2↑ 冰晶石
4Al +3O2↑ 冰晶石(7)Br2+ SO2 +2H2O=4H+ + SO42- + 2Br-
试题分析:①~⑩各元素分别为Na、K、Mg、Ca、Al、C、N、Cl、Br和Ar。(1)电子层数最多的元素,其原子半径最大;(2)元素最高价氧化物对应的水化物酸性最强,则该元素的非金属性最强;(3)M物质为NH4NO3,离子化合物,含有离子键和共价键;(4)元素③与⑧形成化合物氯化镁,离子化合物,故用箭头表示电子的转移;(5)元素⑥的氢化物为CxHy,电子为12x+y=32,x、y之间的关系还应符合烷烃或烯烃或炔烃的通式;(6)Al是活泼金属,工业冶炼需用电解法。
点评:元素周期表及其规律是高考必考知识点,考生在备考中应注意积累掌握短周期元素的结构与性质。

练习册系列答案
相关题目