题目内容
短周期原子序数依次递增的A、B、C、D、E、F六种元素,已知B原子最外层电子数是A原子次外层电子数的3倍,是D原子最外层电子数的2倍;C原子内层电子总数是最外层电子数10倍;A、B、D三种元素的原子最外层电子数之和为13;A和B原子最外层电子数之和与D和F原子最外层电子数之和相等;D和E是相邻两种元素。
(1)E元素基态原子的核外电子占用了 个原子轨道 。
(2)A、B、C三种元素组成原子个数比为n(A):n(B):n(C)=1:3:2的化合物,该化合物的水溶液显 (填“酸性”“碱性”“中性”),原因用离子方程式可表示为 。
(3)B、C、D三种元素离子半径最小的是 (填离子符号);AB2 分子的电子式
是 。M元素与D元素位于不同主族,但由于二者的电负性相近,导致某些性
相似,将M的最高价氧化物溶于C的氢氧化物的水溶液中,发生反应的离子方程式为 。
(4)E和F形成的化合物X容易水解生成两种酸,写出该水解反应的化学方程式 。
(1)E元素基态原子的核外电子占用了 个原子轨道 。
(2)A、B、C三种元素组成原子个数比为n(A):n(B):n(C)=1:3:2的化合物,该化合物的水溶液显 (填“酸性”“碱性”“中性”),原因用离子方程式可表示为 。
(3)B、C、D三种元素离子半径最小的是 (填离子符号);AB2 分子的电子式
是 。M元素与D元素位于不同主族,但由于二者的电负性相近,导致某些性
相似,将M的最高价氧化物溶于C的氢氧化物的水溶液中,发生反应的离子方程式为 。
(4)E和F形成的化合物X容易水解生成两种酸,写出该水解反应的化学方程式 。
(1)8 (2)碱性 CO32- + H2O HCO3- +OH-
HCO3- +OH-
(3)Al3+ ; ; BeO + 2OH-=BeO22- + H2O
; BeO + 2OH-=BeO22- + H2O
(4)SiCl4 + 3H2O=4HCl + H2SiO3↓
 HCO3- +OH-
HCO3- +OH-(3)Al3+ ;
 ; BeO + 2OH-=BeO22- + H2O
; BeO + 2OH-=BeO22- + H2O(4)SiCl4 + 3H2O=4HCl + H2SiO3↓
试题分析:C原子内层电子总数是最外层电子数10倍,这说明C一定是钠元素。B原子最外层电子数是A原子次外层电子数的3倍,是D原子最外层电子数的2倍;且AB的原子序数小于钠元素的,所以B应该是氧元素。由于D的原子序数大于钠元素的,所以D是Al元素。A、B、D三种元素的原子最外层电子数之和为13,所以A元素的最外层电子数是4个,即A是碳元素。A和B原子最外层电子数之和与D和F原子最外层电子数之和相等,所以F的最外层电子数是7个,则F是氯元素。D和E是相邻两种元素,其中E的原子序数大于铝的,小于氯元素的,则E是Si元素。
(1)根据构造原理可知,Si元素的核外电子排布是1s22s22p63s23p2,则Si元素基态原子的核外电子占用了8个原子轨道。
(2)A、B、C三种元素组成原子个数比为n(A):n(B):n(C)=1:3:2的化合物,该化合物碳酸钠,溶于水水解显碱性,水解方程式是CO32- + H2O
 HCO3- +OH-。
HCO3- +OH-。(3)核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,则B、C、D三种元素离子半径最小的是Al3+;CO2是含有极性键的共价化合物,电子式是
 ;M元素与D元素位于不同主族,但二者的电负性相近,所以M是Be元素,氧化铝是两性氧化物,则氧化铍能溶于氢氧化钠溶液中,反应的离子方程式是BeO + 2OH-=BeO22- + H2O。
;M元素与D元素位于不同主族,但二者的电负性相近,所以M是Be元素,氧化铝是两性氧化物,则氧化铍能溶于氢氧化钠溶液中,反应的离子方程式是BeO + 2OH-=BeO22- + H2O。(4)根据原子守恒可知,生成的两种酸应该是盐酸和硅酸,反应的化学方程式是SiCl4+3H2O=4HCl+H2SiO3↓。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。

练习册系列答案
相关题目
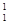 H组成HmX分子。在agHmX中所含质子的物质的量是
H组成HmX分子。在agHmX中所含质子的物质的量是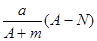 mol
mol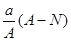 mol
mol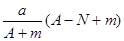 mol
mol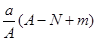 mol
mol Nd、
Nd、 Nd 和
Nd 和 Nd 互为同素异形体
Nd 互为同素异形体