题目内容
【题目】25 ℃时,在20 mL 0.1 mol·L-1NaOH溶液中加入0.2 mol·L-1CH3COOH溶液,所加入的溶液的体积(V)和混合液中pH变化关系的曲线如图所示,若B点的横坐标a=10,下列说法正确的是( )
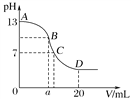
A. A~B间任意一点都满足c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B. B点时,c(Na+)>c(CH3COO-)+c(CH3COOH)
C. C点时,c(Na+)>c(CH3COO-)>c(H+)=c(OH-)
D. A~D间任意一点都满足c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
【答案】D
【解析】A.A~B间溶液显碱性,不能确定氢氧根和醋酸根离子浓度之间的大小关系,如果加入的醋酸少量,则c(Na+)>c(OH-)>c(CH3COO-)>c(H+),如果加入的醋酸达到一定程度,则会出现c(Na+)>c(CH3COO-)>c(OH-)>c(H+),A错误;B.在B点时,溶液pH>7,溶质可能是醋酸钠或醋酸钠和氢氧化钠的混合溶液,因此不能确定c(Na+)与c(CH3COO-)+c(CH3COOH)之间的关系,B错误;C.在C点溶液显中性,则c(OH-)=c(H+),根据电荷守恒c(Na+)+c(H+)=c(CH3COO-)+c(OH-),则一定有c(Na+)=c(CH3COO-),溶液中离子浓度大小关系为:c(Na+)=c(CH3COO-)>c(OH-)=c(H+),C错误;D.根据电荷守恒可知A~D间任意一点都满足c(Na+)+c(H+)=c(CH3COO-)+c(OH-),D正确,答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu.Fe三种金属元素组成,回答下列问题:
(1)①铜元素位于周期表中_____区。Cu2+离子的价层轨道表示式为____。
②锰、铁、钴三种元素的逐级电离能如下表:
电离能/KJ/mol | I1 | I2 | I 3 | I4 |
Mn | 717.3 | 1509.0 | 3248 | 4940 |
Fe | 762.5 | 1561.9 | 2957 | 5290 |
Co | 760.4 | 1648 | 3232 | 4950 |
铁元素的第三电离能明显低于锰元素和钴元素,其原因是____。
③实验室可用赤血盐K3[Fe(CN)6]检验Fe2+离子,在赤血盐中铁元素的化合价为____,中心离子的配位数为______。
(2)利用反应:X+C2H2+NH3→Cu2C2+NH4Cl(未配平)可检验乙炔。
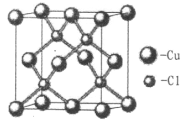
①化合物X晶胞结构如图,据此可知X的化学式为_______。
②乙炔分子中σ键与π键数目之比为______,碳原子的杂化方式为_______;NH4+空间构型为______(用文字描述)。
(3)①下列三种化合物a.AlCl3 b.NaCl c.Al2O3沸点由高到低依次是_______(填编号),其原因是____________。
②Al单质中原子采取面心立方最密堆积,其晶胞边长为0.405nm,列式表示Al单质的密度_______g/cm3(不必计算出结果)。