题目内容
(14分)实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下:
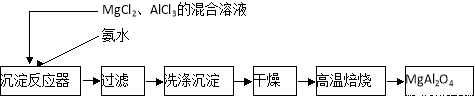
(1)制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式 。
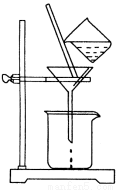
(2)如图所示,过滤操作中的一处错误是 。判断流程中沉淀是否洗净所用的试剂是 。高温焙烧时,用于盛放固体的仪器名称是 。
(3)在25℃下,向浓度均为0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴 加入氨水,先生成 沉淀(填化学式),生成该沉淀的离子方程式 (已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34。)
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。
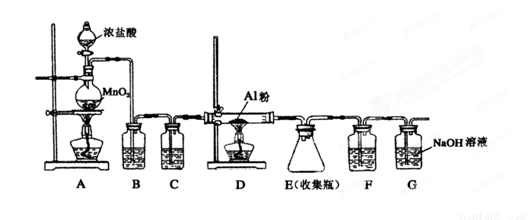
装置B中盛放饱和NaCl溶液,该装置的主要作用是 ;F中试剂的作用是 ;用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 。
(5)将Mg、Cu组成的1.96g混合物投入过量稀硝酸中,充分反应后,固体完全溶解时收集到还原产物NO气体0.896L(标准状况),向反应后的溶液中加入2 mol/L的NaOH溶液80 mL时金属离子恰好完全沉淀。则形成沉淀的质量为 g。
(14分)(1)2Al(OH)3 + Mg(OH)2  MgAl2O4 + 4H2O(2分)
MgAl2O4 + 4H2O(2分)
(2)漏斗下端尖嘴未紧贴烧杯内壁(1分)AgNO3溶液(1分)坩埚(1分)
(3)Al(OH)3(1分) Al3++3NH3·H2O=Al(OH)3↓+3NH4+ (2分)
(4)除去HCl(1分);吸收水蒸气(1分) 碱石灰(2分)
(5)4.00(2分)
【解析】
试题分析:(1)MgCl2、AlCl3的混合溶液与氨水反应生成氢氧化镁和氢氧化铝沉淀,经过滤、洗涤、干燥后高温焙烧生成MgAl2O4,所以该反应的反应物是氢氧化镁和氢氧化铝,产物是MgAl2O4和水,化学方程式为2Al(OH)3 + Mg(OH)2  MgAl2O4 + 4H2O;
MgAl2O4 + 4H2O;
(2)过滤存在中符合“一贴二低三靠”过滤操作中的一处错误是漏斗下端尖嘴未紧贴烧杯内壁;氯化镁与氯化铝在与氨水反应生成沉淀时,沉淀上易附着有氯离子,检验氯离子所用的试剂是硝酸银溶液;高温焙烧时,用于盛放固体的仪器是坩埚;
(3)已知25℃时Ksp[Mg(OH)2]=1.8×10-11>Ksp[Al(OH)3]=3×10-34。所以先生成溶解度小的沉淀Al(OH)3;生成Al(OH)3沉淀的离子方程式为Al3++3NH3·H2O=Al(OH)3↓+3NH4+
(4)因为无水AlCl3遇潮湿空气即产生大量白雾,所以制备氯化铝时要求氯气是干燥的,而且浓盐酸易挥发,挥发的HCl也与Al反应,所以需除去HCl,装置B中盛放饱和NaCl溶液,目的就是除去氯气中的HCl;装置C中盛放浓硫酸,目的是干燥氯气;F中也盛放浓硫酸,目的是吸收G中的水蒸气,防止水蒸气进入D中;可用一件仪器装填适当试剂后也可起到F和G的作用,该试剂既能吸收水,还能吸收多余的氯气,所以应该是碱石灰;
(5)Mg、Cu都是2价金属,沉淀的质量也即Mg、Cu的质量加上OH-的质量。该过程中生成NO气体0.896L(标准状况)物质的量是0.04mol,则Mg、Cu失去电子的物质的量等于NO3-得电子的物质的量也等于OH-的物质的量,即n(OH-)=0.04mol×3=0.12mol,所以沉淀的质量是1.96g+0.12mol×17g/mol=4g。
考点:考查镁、铝化合物的性质,化学方程式的判断与书写,装置的作用判断,氧化还原反应的计算

(15分)
某研究小组想研究碳与浓硝酸的反应。其实验过程如下。
操作 | 现象 |
|
|
b.把小块烧红的木炭迅速伸入热的浓硝酸中。 | 红热的木炭与热的浓硝酸接触发生剧烈反应,同时有大量红棕色气体产生,液面上木炭迅速燃烧,发出光亮。 |
(1)热的浓硝酸与红热的木炭接触会发生多个化学反应。
① 碳与浓硝酸的反应,说明浓硝酸具有 性。
② 反应产生的热量会使少量浓硝酸受热分解,产生红棕色气体、一种无色无味的单质气体X和水,气体X的化学式是 。
(2)实验现象中液面上木炭迅速燃烧,发出光亮。同学甲认为可能是木炭与气体X反应产生的现象;同学乙猜测NO2可能具有助燃性,木炭能在NO2中燃烧。他们设计了以下实验。
Ⅰ.制取NO2气体。
① 在虚线框内画出用铜与浓硝酸制取和收集NO2的装置简图(夹持仪器略)。
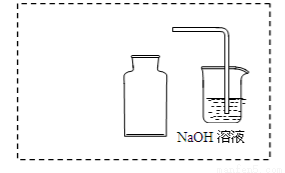
② NaOH溶液的作用是吸收多余的NO2,该反应生成两种物质的量相等的正盐,写出反应的化学方程式 。
Ⅱ.探究实验。
实验操作:在空气中引燃木炭,使其燃烧并带有火焰,将带火焰的木炭伸入盛有NO2气体的集气瓶中。
实验现象:木炭在NO2气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
① 根据实验现象写出碳与NO2气体反应的化学方程式 。
② 试分析是否需要增加带火焰的木炭与纯净的X气体反应的实验 。
③ 通过实验探究,你认为甲、乙同学的预测是否合理,请简述理由 。
14 分苯甲酸乙酯(C9H10O2)别名为安息香酸乙酯。 它是一种无色透明液体,不溶于水,稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体,溶剂等。其制备方法为:
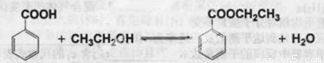
已知:
名称 | 相对分子质量 | 颜色,状态 | 沸点(℃) | 密度(g·cm-3) |
苯甲酸* | 122 | 无色片状晶体 | 249 | 1.2659 |
苯甲酸乙酯 | 150 | 无色澄清液体 | 212.6 | 1.05 |
乙醇 | 46 | 无色澄清液体 | 78.3 | 0.7893 |
环己烷 | 84 | 无色澄清液体 | 80.8 | 0.7318 |
已知:苯甲酸在100℃会迅速升华。
实验步骤如下:
①在圆底烧瓶中加入4.0g苯甲酸,10 mL 95%的乙醇(过量),8mL 环己烷以及3 mL 浓硫酸,混合均匀并加入沸石,按右图所示装好仪器,控制温度在65~70℃加热回流2 h。利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
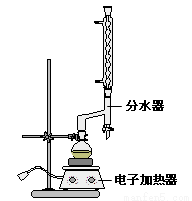
②反应一段时间,打开旋塞放出分水器中液体后,关闭旋塞,继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液至呈中性。用分液漏斗分出有机层,水层用25 mL乙醚萃取分液,然后合并至有机层,加入氯化钙,静置,过滤,对滤液进行蒸馏,低温蒸出乙醚和环己烷后,继续升温,接收210~213℃的馏分。
④检验合格,测得产品体积为2.3mL。
回答下列问题:
(1)在该实验中,圆底烧瓶的容积最适合的是 (填入正确选项前的字母)。
A.25 mL B.50 mL C.100 mL D.250 mL
(2)步骤①加入沸石的作用是 。如果加热一段时间后发现忘记加沸石,应该采取的正确操作是:
(3)步骤①中使用分水器不断分离除去水的目的是
(4)步骤③加入Na2CO3加入不足,在之后蒸馏时蒸馏烧瓶中可见到白烟生成,产生该现象的原因 ;
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须
(6)计算本实验的产率为 。
下列离子组在一定条件下能大量共存,当加入相应试剂后会发生化学变化,且所给离子方程式正确的是 ( )
选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
A | Fe2+、NO | 稀硫酸 | 3Fe2++NO |
B | Fe3+、I-、ClO- | 氢氧化钠溶液 | Fe3++3OH-=Fe(OH)3↓ |
C | Ba2+、HCO | 氢氧化钠溶液 | HCO |
D | Al3+、Cl-、NO | 过量氢氧化钠溶液 | Al3++3 OH-=Al(OH)3↓ |
(14分)2013年12月2日,我国在西昌卫星发射中心用“长征三号甲”运载火箭将“嫦娥三号”探月卫星成功送入太空,进一步向广寒宫探索。“长征三号甲”是三级液体助推火箭,一、二级为常规燃料,常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。
Ⅰ.常规燃料通常指以肼(N2H4)为燃料,以二氧化氮做氧化剂。但有人认为若用氟气代替二氧化氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:①N2H4(g)+O2(g)=N2(g)+2H2O(g) △H = -543kJ·mol-1
②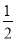 H2(g)+
H2(g)+ 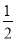 F2(g) = HF(g) △H = -269kJ·mol-1
F2(g) = HF(g) △H = -269kJ·mol-1
③H2(g)+ 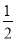 O2(g) = H2O(g) △H = -242kJ·mol-1
O2(g) = H2O(g) △H = -242kJ·mol-1
请写出肼和氟气反应的热化学方程式:_____________________________。
Ⅱ.氧化剂二氧化氮可由NO和 O2生成,已知在2 L密闭容器内,800 ℃时反应:
2NO(g)+O2(g)  2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
2NO2(g) ΔH 的体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.200 | 0.100 | 0.080 | 0.050 | 0.050 | 0.050 |
n(O2)(mol) | 0.100 | 0.050 | 0.040 | 0.025 | 0.025 | 0.025 |
(1)已知:K800℃>K1000℃,则该反应的ΔH ______0(填“大于”或“小于”),用O2表示从0~2 s内该反应的平均速率为__________。
(2)能说明该反应已达到平衡状态的是________。
A.容器内颜色保持不变 B. 2v逆(NO)=v正(O2)
C.容器内压强保持不变 D.容器内密度保持不变
(3)为使该反应的速率增大,提高NO的转化率,且平衡向正反应方向移动应采取的措施有 。
(4)在上述条件下,计算通入2 mol NO和1 mol O2的平衡常数K=______________。
(5)在上述条件下,若开始通入的是0.2 mol NO2气体,达到化学平衡时,则NO2的转化率为 。