题目内容
【题目】据人民网报道,有一集团拟将在太空建立巨大的集光装置,把太阳光变成激光用于分解海水制氢,其反应可表示为:2H2O ![]() 2H2↑+O2↑.有下列几种说法:
2H2↑+O2↑.有下列几种说法:
①水分解反应是放热反应;
②氢气是一级能源;
③使用氢气作燃料有助于控制温室效应;
④若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件.
其中叙述正确的是( )
A.①②
B.②③
C.③④
D.①②③④
【答案】C
【解析】①把太阳光变成激光用于分解海水制氢,太阳光提供能量,所以,水分解反应是吸热反应,故①不符合题意;
②自然界中没有现存的氢气,把太阳光变成激光用于分解海水制氢,说明氢气为二级能源,故②不符合题意;
③温室效应产生的原因是二氧化碳的增多,使用氢气作燃料2H2+O2 ![]() 2H2O,能减少二氧化碳的含量,有助于控制温室效应,故③符合题意;
2H2O,能减少二氧化碳的含量,有助于控制温室效应,故③符合题意;
④甲醇是重要的化工原料,也可作燃料,CO2+3H2 ![]() CH3OH+H2O,可减少二氧化碳的排放,同时储存能源,可改善生存条件,故④符合题意;
CH3OH+H2O,可减少二氧化碳的排放,同时储存能源,可改善生存条件,故④符合题意;
故答案为:C.
①水分解反应是吸热的;
②自然界中以现成形式提供的能源称为一级能源;需要依靠其它能源的能量间接制取的能源称为二级能源;
③氢气作燃料燃烧产物为水,温室效应与二氧化碳的排放有关;
④二氧化碳与氢气反应生成甲醇,可减少二氧化碳的排放,同时储存能源.

【题目】根据题干内容填空:
(1)某温度下,Kw=10﹣12 . 若保持温度不变,向少量水中加入g的NaOH固体,并加水稀释至1L,才能使溶液中水电离产生的H+、OH﹣的浓度乘积即:c(H+)水c(OH﹣)水=10﹣26 . 若保持温度不变,向水中通入的HCl气体恰好使溶液中c(H+)/c(OH﹣)=1010 , 则此时水电离的c(OH﹣)=molL﹣1 .
(2)一定温度下,现有a.盐酸,b.硫酸,c.醋酸 三种酸
①当三种酸体积相同,物质的量浓度相同时,使其恰好完全中和所需NaOH的物质的量由大到小的顺序是 . (用a、b、c表示)
②当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是 . (用a、b、c表示)
③当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为 . (用a、b、c表示)
(3)现有两瓶pH=2的盐酸和醋酸溶液,简述如何用最简单的方法区别盐酸和醋酸.(限选试剂:石蕊试液、酚酞试液、pH试纸、蒸馏水).采用的方法为 .
(4)执信中学A学生为了测定某烧碱样品的纯度,准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液.用0.200 0molL﹣1的标准盐酸进行滴定,选择甲基橙作指示剂,试根据实验回答下列问题:
①滴定过程中,眼睛应注视;滴定终点时,溶液从色变为色, .
②观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果(填“偏高”、“偏低”或“无影响”);若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果(填“偏高”、“偏低”或“无影响”).
③根据如表数据,通过标准酸滴定,计算待测烧碱溶液的物质的量浓度是 , 烧碱样品的纯度是 . (本小题计算结果保留4位有效数字)
滴定次数 | 待测溶液 | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的 | ||
第①次 | 10.00 | 0.40 | 20.50 |
第②次 | 10.00 | 4.10 | 24.00 |
第③次 | 10.00 | 2.20 | 23.80 |
【题目】某研究性学习小组对铝热反应实验展开研究。现行高中化学教材中对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | -- |
Ⅰ.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理?答:_____ (填“合理”或“不合理”)
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是_____ ,反应的离子方程式为____ __。
(3)实验室溶解该熔融物,下列试剂中最好的是___ ___(填序号)。
A.浓硫酸 B.稀硫酸 C.稀硝酸 D.氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4molL-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。试回答下列问题:
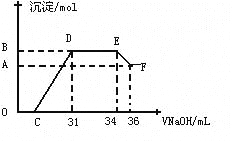
(4)图中OC段没有沉淀生成,此阶段发生反应的离子方程式为____ __
(5)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为____ _ ,上述现象说明溶液中_____ _结合OH—的能力比___ ___强(填离子符号)。
(6)B点对应的沉淀的物质的量为____ __mol,C点对应的氢氧化钠溶液的体积为____ __mL。