��Ŀ����
����Ŀ��ij�о���ѧϰС������ȷ�Ӧʵ��չ���о������и��л�ѧ�̲��ж������ȷ�Ӧ��������������������������Ӧ�ų��������ȣ�������ҫ�۵Ĺ�â������ֽ©�����²����մ���������������ɳ���������ġ���ѧ�ֲᡷ֪��Al��Al2O3��Fe��Fe2O3�۵㡢�е��������£�
���� | Al | Al2O3 | Fe | Fe2O3 |
�۵�/�� | 660 | 2054 | 1535 | 1462 |
�е�/�� | 2467 | 2980 | 2750 | -- |
������1��ijͬѧ�Ʋ⣬���ȷ�Ӧ���õ���������Ӧ�������Ͻ������ǣ��÷�Ӧ�ų�������ʹ���ۻ����������۵�����ͣ���ʱҺ̬���������ۺ��γ������Ͻ�����Ϊ���Ľ����Ƿ��������_____ ��������������������������
��2�����һ����ʵ�鷽����֤���������õĿ�״�������к��н���������ʵ�������Լ���_____ ����Ӧ�����ӷ���ʽΪ____ __��
��3��ʵ�����ܽ������������Լ�����õ���___ ___������ţ���
A��Ũ���� B��ϡ���� C��ϡ���� D������������Һ
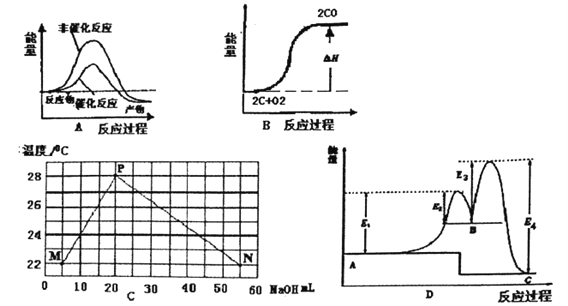
����ʵ���о����֣����ᷢ��������ԭ��Ӧʱ�������Ũ��Խϡ����Ӧ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�͡�ijͬѧȡһ������������������һ������ϡ�������ַ�Ӧ����Ӧ������������ų����ڷ�Ӧ���������Һ�У���μ���4molL-1������������Һ����������������Һ�������mL��������ij��������ʵ�����mol���Ĺ�ϵ��ͼ��ʾ���Իش��������⣺
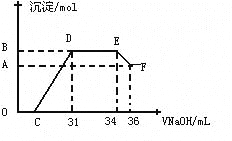
��4��ͼ��OC��û�г������ɣ��˽η�����Ӧ�����ӷ���ʽΪ____ __
��5����DE�Σ����������ʵ���û�б仯����˽η�����Ӧ�����ӷ���ʽΪ____ _ ����������˵����Һ��_____ _���OH����������___ ___ǿ�������ӷ��ţ���
��6��B���Ӧ�ij��������ʵ���Ϊ____ __mol��C���Ӧ������������Һ�����Ϊ____ __mL��
���𰸡�����1������
��2��NaOH��Һ��2Al+2OH��+H2O=2AlO2��+3H2����
��3��B��
����4��H++OH���TH2O
��5��NH4++OH���TNH3H2O��Al3+��Fe3+��H+��NH4+��
��6��0.032��7��
���������������������1�������۵�����ͣ���������Һ̬��һ����䵽ʢ��ɳ�ӵ��������γɺϽ��������ȷ�Ӧ���õ����������������Ͻ����Ժ�������2����������������Һ��Ӧ�������壬���Կ������������Ƽ������õ����������Ƿ���������Ӧ����ʽΪ2Al+2OH��+H2O=2AlO2��+3H2������3��A��Ũ������ʹ�����ۻ�������ʹ�Ͻ��ܽ⣬����B�����ý�����ϡ���ᷴӦ����������ܽ���ϡ�����У���ȷ��C��ϡ�����������Ӧ������Ⱦ�����壬�������ѡ����D���������������Ʒ�Ӧ�����ܽ�������ȫ���ܽ⣬��������ѡB������4��O��C֮�䷢���ķ�Ӧ������кͷ�Ӧ�����ӷ���ʽΪH++OH���TH2O ����5��DEһ�γ���������û�б仯���÷�ӦΪ笠����������������ӽ������һˮ�ϰ�������ʽΪNH4++OH���TNH3H2O����������˵����Һ�����Ƚ�����������ӵ��������ӣ�Ȼ��Ϊ�����Ӻ������ӣ���������������ӵ���笠����ӣ�������Һ�е����ӽ�����������ӵ�������ǿ���������ӣ�������Ϊ笠����ӡ���6����ͼ��֪��EF�����ĵ�����������ҺΪ36-34=2mL���ü���μ���Ӧ���������Ƶ����ʵ���Ϊ0.002��4=0.008mol�����ݷ���ʽ���㣬�������������ʵ���Ϊ0.008Ħ������������������Ϊ0.008Ħ��������Ϊxmol����Ϊ0.008mol�����ɵ������Ϊ��34-31����0.001��4=0.012mol�������������������Ӧ�������������ɵ����غ������3x+0.008��3=0.012��3 x=0.024mol������Ӧ�����������������ʵ���Ϊ0.024mol�����ɳ����������ʵ���Ϊ0.008+0.024=0.032mol���μ������������Ϊ31mLʱ�������Ӻ������Ӻ������Ӷ���Ӧ����C������������Һ�����Ϊ0.031-0.024��3/4-0.008��3/4="0.00" 7L����7mL��

����Ŀ��ij�¶��£�H2��g��+CO2 ��g��H2O��g��+CO��g����ƽ�ⳣ��K= ![]() �����¶����ڼס��ҡ������������ܱ������У�Ͷ��H2 ��g����CO2 ��g��������ʼŨ�������ʾ�������жϲ���ȷ���ǣ�������
�����¶����ڼס��ҡ������������ܱ������У�Ͷ��H2 ��g����CO2 ��g��������ʼŨ�������ʾ�������жϲ���ȷ���ǣ�������
��ʼŨ�� | �� | �� | �� |
c��H2��/molL��1 | 0.010 | 0.020 | 0.020 |
c��CO2��/molL��1 | 0.010 | 0.010 | 0.020 |
A.ƽ��ʱ������CO2��ת���ʴ���60%
B.ƽ��ʱ�����кͱ���H2��ת���ʾ���60%
C.ƽ��ʱ������c��CO2���Ǽ��е�2������0.008 molL��1
D.��Ӧ��ʼʱ�����еķ�Ӧ������죬���еķ�Ӧ��������