题目内容
【题目】锑(Sb)是第VA族元素,其单质主要用于制造合金、半导体。三氧化二锑俗称锑白,是白色粉末,不溶于水,是一种两性氧化物,主要用于白色颜料、油漆和塑料、石油化工等。某工厂用羽毛矿(主要成分为Pb4FeSb6S14)制取锑白的工艺流程如图所示:

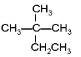
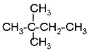
(1)Pb4FeSb6S14中的锑元素只显一种化合价,则其化合价是______。X是一种固体单质,其成分是___(填化学式)。
(2)氯化浸出中,除铅与X外,被氧化的元素反应后均显高价,写出相应的化学方程式:______________。操作1为加水稀释,写出生成SbOCl的离子方程式:___________。
(3)试剂1通常选用氨水而不是NaOH溶液,最可能的原因是_______。操作2的内容是_________、干燥。
(4)在强碱性条件下电解Na3SbS3溶液(原理如图)可得到单质锑。

写出阴极的电极反应式:_______,B电极应接电源的______极,当有2 mol Sb生成时,通过阳离子交换膜的离子数为_________(设NA为阿伏加德罗常数的值)。
【答案】+3 S 2Pb4FeSb6S14+41Cl2=8PbCl2+2FeCl3+12SbCl5+28S Sb3++Cl-+H2O=SbOCl↓+2H+ Sb2O3可溶解在过量的NaOH溶液中,但不会溶解在过量的氨水中 过滤、洗涤 SbS33-+3e-=Sb+3S2- 正 6NA
【解析】
(1)锑是第VA 族元素,主要化合价为+5、+3。Pb4FeSb6S14中硫元素显 -2价,由元素化合价与原子结构关系及化合物中元素化合价代数和等于0可推知锑的化合价为+3价。X是一种固体单质,结合常见元素单质的状态可推知X只能是硫;
(2)由被氧化的元素反应后均显高价知,反应后有FeCl3、SbCl5生成,再结合流程图知还有PbCl2、S生成,由此可写出相应的化学方程式。稀释可促进水解,因SbOC1是通过水解反应生成的,故反应物有Cl-、H2O、Sb3+,据此可得水解方程式;
(3)根据Sb2O3是两性氧化物,能够与强酸、强碱发生反应,不能与弱酸、弱碱反应分析;根据物质的溶解性及操作目的分析解答;
(4)阴极上发生得电子的还原反应,电解Na3SbS3得到单质Sb,故阴极上为SbS33-得到电子产生Sb 及S2-。结合装置电荷守恒分析通过交换膜的阳离子数目。
(1)锑是第VA 族元素,主要化合价为+5、+3。在Pb4FeSb6S14中硫元素显 -2价,Pb为+2价,Fe为+2价,假设Sb元素化合价为+x,根据化合物中元素化合价代数和等于0可得4×2+2+6x=2×14,解得x=+3价。羽毛矿主要成分为Pb4FeSb6S14,向其中加入水,然后通入Cl2进行氧化反应,金属变为金属氯化物,S被氧化为S单质,S单质在常温下为固体,所以X只能是硫;
(2)根据题意可知:羽毛矿Pb4FeSb6S14与氯气反应时,S被氧化变为S单质,Pb变为PbCl2,其余元素被氧化为高价态,则根据原子守恒、电子守恒,可得该反应的化学方程式:2Pb4FeSb6S14+41Cl2=8PbCl2+2FeCl3+12SbCl5+28S;操作1为加水稀释,生成难溶性的SbOCl,根据盐的水解规律,结合电荷守恒、原子守恒可得Sb3++Cl-+H2O=SbOCl↓+2H+;
(3)由题意可知Sb2O3是两性氧化物,能够与强碱NaOH发生反应,所以Sb2O3可溶解在过量的NaOH溶液中,但不会溶解在过量的氨水中,因此试剂1通常选用氨水而不是NaOH溶液;分离难溶性固体与可溶性液体混合物使用过滤方法,然后经沉淀经洗涤、干燥得到锑白;
(4)与电源负极连接的电极为阴极,得到电子发生还原反应,由题意可知:电解Na3SbS3溶液得到Sb单质,则在阴极上发生反应:SbS33-+3e-=Sb+3S2-,故A为电源的负极,B为电源的正极;根据电解时阴极电极式可知:每产生1 mol Sb,转移3 mol电子,则生成2 mol Sb时,转移6 mol电子,同时得到6 mol S2-,根据溶液呈电中性可知要有6 mol Na+通过阳离子交换膜,通过了Na+数目为6NA。

 阶梯计算系列答案
阶梯计算系列答案【题目】下列实验操作、现象、得出的结论均正确的是
选项 | 实验操作和现象 | 结论 |
A | 某溶液 | 原溶液中一定含有CO32- |
B | 用湿润的pH试纸测某碱液的pH,测定值偏小 | 湿润的pH试纸测量任何溶液都会产误差 |
C | 将浓硫酸倒入蔗糖中搅拌蔗糖迅速变黑并伴有刺激性气味 | 浓硫酸具有脱水性和强氧化性 |
D | 将乙烯和苯分别加入到溴水中,都能使溴水层褪色 | 乙烯和苯分子中都含有碳碳双键 |
A. A B. B C. C D. D
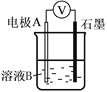
【题目】某小组同学利用原电池装置探究物质的性质。资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
(1)同学们利用下表中装置进行实验并记录。
装置 | 编号 | 电极A | 溶液B | 操作及现象 |
| Ⅰ | Fe | pH=2的H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
①同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是_____________。
②针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是_______;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是___________。
(2)同学们仍用上述装置并用Cu和石墨为电极继续实验,探究实验Ⅱ指针偏转原因及影响O2氧化性因素。
编号 | 溶液B | 操作及现象 |
Ⅲ | 经煮沸的pH=2的 H2SO4 | 溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
Ⅳ | pH=2的H2SO4 | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
Ⅴ | pH=12的NaOH | 在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
①丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是____________。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究_____________________对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是_____________。