题目内容
【题目】大气中CO2含量的增加会加剧温室效应,为减少其排放,需将工业生产中产生的CO2分离出来进行储存和利用。
(1)CO2与NH3反应可合成化肥尿素[化学式为CO(NH2)2],反应2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g)在合成塔中进行。如图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[
CO(NH2)2(l)+H2O(g)在合成塔中进行。如图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比[![]() ]和水碳比[
]和水碳比[![]() ]投料时二氧化碳转化率的情况。
]投料时二氧化碳转化率的情况。
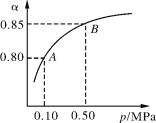
①曲线Ⅰ、Ⅱ、Ⅲ水碳比的数值范围分别为0.6~0.7、1~1.1和1.5~1.61,则生产中应选用水碳比的数值范围为_________________。
②请推测生产中氨碳比控制在4.0左右还是控制在4.5左右比较适宜,并简述你的理由__________________。

(2)CO2与H2也可用于合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。在体积可变的恒压密闭容器中,该反应在不同温度、不同投料比时,CO2的平衡转化率如图2所示。
CH3OH(g)+H2O(g)。在体积可变的恒压密闭容器中,该反应在不同温度、不同投料比时,CO2的平衡转化率如图2所示。
①该反应的化学平衡常数的表达式为_______________________。
②该反应的ΔS___0
③已知: ① CO(g)+2H2(g) CH3OH(g) ΔH= -90.1 kJ·mol-1 ②CO(g) +H2O(g) CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1,则CO2与H2反应合成CH3OH(g)的热化学方程式为___________________。
④700K投料比[![]() ]=2时,H2的平衡转化率为______________。
]=2时,H2的平衡转化率为______________。
【答案】0.6~0.7 4.0比较适宜;氨碳比在4.5时,NH3的量增大较多,而CO2转化率增加不大,提高了生产成本 K=![]() < CO2(g)+ 3H2 (g)= CH3OH(g) ΔH=-49kJ/mol 45%
< CO2(g)+ 3H2 (g)= CH3OH(g) ΔH=-49kJ/mol 45%
【解析】
(1)①依据反应转化率的大小分析,结合图象分析判断;
②氨碳比在4.5时氨气量增大对二氧化碳的转化率增加不大;
(2)①根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行书写;
②根据反应前后气体的物质的量大小判断△S;
③根据盖斯定律进行计算;
④由图可知,在700K,投料比[![]() ]=2时,二氧化碳转化率为30%,令CO2、H2的起始物质的量分别为1mol、2mol,转化的二氧化碳为0.3mol,根据方程式可知转化的氢气为0.9mol,进而计算H2 的转化率;
]=2时,二氧化碳转化率为30%,令CO2、H2的起始物质的量分别为1mol、2mol,转化的二氧化碳为0.3mol,根据方程式可知转化的氢气为0.9mol,进而计算H2 的转化率;
(1)①由图像可知,在相同条件下,水碳比越小,二氧化碳的转化率越高,所以生产中应选用水碳比的数值范围为0.6~0.7;
②氨碳比在4.0左右时,二氧化碳的转化率与4.5时相差不大,所以生产中氨碳比控制在4.0左右比较适宜。氨碳比在4.5时,NH3的量增大较多,而CO2转化率增加不大,提高了生产成本;
(2)①反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的化学平衡常数的表达式为K=
CH3OH(g)+H2O(g)的化学平衡常数的表达式为K=![]() ;
;
②该反应正反应方向是气体分子数减少的方向,所以S <0;
③已知: ① CO(g)+2H2(g) CH3OH(g) ΔH= -90.1 kJ·mol-1
②CO(g) +H2O(g) CO2(g)+H2(g) ΔH= -41.1 kJ·mol-1
根据盖斯定律,由①-②得反应CO2(g)+ 3H2 (g)= CH3OH(g) ΔH= -90.1 kJ·mol-1-(-41.1 kJ·mol-1)=-49kJ/mol,则CO2与H2反应合成CH3OH(g)的热化学方程式为CO2(g)+ 3H2 (g)= CH3OH(g) ΔH=-49kJ/mol;
④由图像可知,700K投料比[![]() )] = 2时,二氧化碳的转化率为30%。假设氢气和二氧化碳的起始投料分别为2mol和1mol,则二氧化碳的变化量为1mol×30%=0.3mol,由反应方程式CO2(g)+3H2(g) CH3OH(g)+H2O(g)求出氢气的变化量为0.3mol×3=0.9mol,所以H2的平衡转化率为
)] = 2时,二氧化碳的转化率为30%。假设氢气和二氧化碳的起始投料分别为2mol和1mol,则二氧化碳的变化量为1mol×30%=0.3mol,由反应方程式CO2(g)+3H2(g) CH3OH(g)+H2O(g)求出氢气的变化量为0.3mol×3=0.9mol,所以H2的平衡转化率为![]() =45%。
=45%。