题目内容
【题目】某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”;“纸漏斗的下部被烧穿,有熔融物落入沙中”。由化学手册查阅得有关物质的熔、沸点数据如下表。
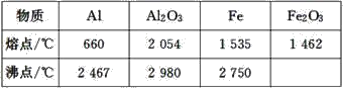
(1)该同学推测,铝热反应所得到的熔融物应是铁铝合金。理由是该反应放出的热量使铁熔化,而铝的熔点比铁的低,此时液态的铁和铝熔合成铁铝合金,你认为他的解释是否合理_(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是__,反应的离子方程式为_。
(3)实验室溶解该熔融物,下列试剂中最好的是__(填序号),并说明理由:__。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
【答案】合理 NaOH溶液 2Al+2OH-+2H2O=2AlO2-+3H2↑ B 若用A、C溶解样品会产生SO2、NO等有毒气体,用D,则Fe不会与NaOH溶液反应,而用B既能将样品全部溶解,又不会生成有害气体
【解析】
(1)根据表中各物质的熔点分析,铁和铝能否熔合成铁铝合金;
(2)由于金属铝可以与NaOH溶液反应而铁不能;铝与NaOH溶液反应的生成NaAlO2和H2,据此分析;
(3)要将熔融物全部溶解,则加入试剂必须既可以与铝反应也必须与铁反应,且环保无害;
(1)根据表中各物质的熔点,铁和铝可以熔合成铁铝合金,故解释合理;
故答案为:合理;
(2)由于金属铝可以与NaOH溶液反应而铁不能,故可以选用的试剂为NaOH溶液;铝与NaOH溶液反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:NaOH溶液;2Al+2OH-+2H2O=2AlO2-+3H2↑;
(3)要将熔融物全部溶解,则加入试剂必须既可以与铝反应也必须与铁反应。若用A、C溶解样品会产生SO2、NO等有毒气体,用D,则Fe不会与NaOH溶液反应,而用B既能将样品全部溶解,又不会生成有害气体,
故答案为:B;若用A、C溶解样品会产生SO2、NO等有毒气体,用D,则Fe不会与NaOH溶液反应,而用B既能将样品全部溶解,又不会生成有害气体。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某化学学习小组设计以下实验方案,测定某含有NaCl的小苏打样品中![]() 的质量分数。
的质量分数。
(方案一)查资料:NaCl加热至![]() 时熔化而不分解,
时熔化而不分解,![]() 受热分解,
受热分解,![]() 。由此设计实验:用电子天平称取
。由此设计实验:用电子天平称取![]() 样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于
样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于![]() ,不超过
,不超过![]() ),至恒重后,冷却,称量剩余固体质量为
),至恒重后,冷却,称量剩余固体质量为![]() 。
。
(1)实验中至少称量____次。
(2)实验中,达到恒重操作的标准是__________。
(方案二)根据“![]() 溶液呈碱性,
溶液呈碱性,![]() ”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
1 | 2 | |
| 20.00 | 20.00 |
| 0.00 | 0.20 |
| 19.98 | 20.22 |
(3)实验中,当其它操作均正确时,下列操作不会引起实验误差的是(______)。
A.容量瓶用蒸馏水洗净后,瓶内有水残留,直接配制溶液
B.滴定管内壁有水珠就装入标准液
C.锥形瓶内壁有水珠,用待测液润洗后再使用
D.锥形瓶用蒸馏水洗净后,直接放入待测液进行测定
span>(4)滴定终点的判断:__________。
(5)两次实验消耗盐酸体积的平均值为__________mL。
(6)样品中![]() 的质量分数__________。
的质量分数__________。