题目内容
【题目】某化学学习小组设计以下实验方案,测定某含有NaCl的小苏打样品中![]() 的质量分数。
的质量分数。
(方案一)查资料:NaCl加热至![]() 时熔化而不分解,
时熔化而不分解,![]() 受热分解,
受热分解,![]() 。由此设计实验:用电子天平称取
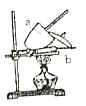
。由此设计实验:用电子天平称取![]() 样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于
样品,置于坩埚中用酒精灯加热(如图,灼烧温度高于![]() ,不超过
,不超过![]() ),至恒重后,冷却,称量剩余固体质量为
),至恒重后,冷却,称量剩余固体质量为![]() 。
。
(1)实验中至少称量____次。
(2)实验中,达到恒重操作的标准是__________。
(方案二)根据“![]() 溶液呈碱性,
溶液呈碱性,![]() ”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
”的性质设计实验:准确称取1.000 g样品,用容量瓶配成100 mL溶液,用滴定管量取20.00 mL于锥形瓶中,加入2滴甲基橙为指示剂,用0.1000mol/L盐酸标准溶液滴定。平行两份,两次实验的数据如下:
1 | 2 | |
| 20.00 | 20.00 |
| 0.00 | 0.20 |
| 19.98 | 20.22 |
(3)实验中,当其它操作均正确时,下列操作不会引起实验误差的是(______)。
A.容量瓶用蒸馏水洗净后,瓶内有水残留,直接配制溶液
B.滴定管内壁有水珠就装入标准液
C.锥形瓶内壁有水珠,用待测液润洗后再使用
D.锥形瓶用蒸馏水洗净后,直接放入待测液进行测定
span>(4)滴定终点的判断:__________。
(5)两次实验消耗盐酸体积的平均值为__________mL。
(6)样品中![]() 的质量分数__________。
的质量分数__________。
【答案】3 两次称量的质量差不大于0.001g AD 溶液由黄色变为橙色,并在半分钟内不变色 20.00mL 84%
【解析】
(1)在进行热分解实验后固体质量分析时,为确保固体分解完全,减少操作误差,对冷却后固体的质量至少称量3次。答案为:3
(2)依据样品的质量1.000 g分析,该电子天平的精度为0.001g,所以,实验中达到恒重操作的标准是两次称量的质量差不大于0.001g。答案为:两次称量的质量差不大于0.001g。
(3)A.容量瓶用蒸馏水洗净后,瓶内有水残留,直接配制溶液,不改变溶质的物质的量,不产生误差;
B.滴定管内壁有水珠就装入标准液,标准液浓度减小,滴定时所用体积增大,但计算时仍用标准液的浓度进行计算,从而使所测待测液的浓度偏大,结果偏高;
C.锥形瓶内壁有水珠,用待测液润洗后再使用,锥形瓶内待测液的物质的量增大,所用标准液的体积增大,所测待测液的浓度偏高;
D.锥形瓶用蒸馏水洗净后,直接放入待测液进行测定,不产生误差。
答案为AD。
(4)起初锥形瓶内加入的是碳酸氢钠溶液,滴加甲基橙呈黄色,滴定达终点时,溶液由黄色逐渐变为橙色,并在半分钟内不变色。答案为:溶液由黄色变为橙色,并在半分钟内不变色
(5)第一次实验消耗盐酸20.02mL,第二次实验消耗盐酸19.98mL,两次实验消耗盐酸体积的平均值为20.00mL。答案为:20.00mL
(6)样品中![]() 的质量分数
的质量分数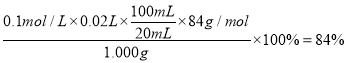
答案为84%

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案