题目内容
已知在甲醛、乙酸、乙酸乙酯组成的混合物中,氧元素的质量分数为58%,则氢元素的质量分数为( )
| A、6% | B、12% |
| C、14% | D、36% |
考点:元素质量分数的计算
专题:计算题
分析:甲醛为CH2O,乙酸为C2H4O2,乙酸乙酯为C4H8O2,各分子中碳原子与氢原子数目之比为1:2,故混合物中碳元素与氢元素的质量之比为12:2=6:1,根据氧元素的质量发生计算混合物中碳元素与氢元素的质量分数之和,再根据碳元素与氢元素质量关系计算.
解答:
解:甲醛为CH2O,乙酸为C2H4O2,乙酸乙酯为C4H8O2,各分子中碳原子与氢原子数目之比为1:2,故混合物中碳元素与氢元素的质量之比为12:2=6:1,混合物中氧的质量分数为58%,则混合物中碳元素与氢元素的质量分数之和为1-58%=42%,故混合物中氢元素的质量分数=42%×
=6%,
故选A.
| 1 |
| 1+6 |
故选A.
点评:本题考查混合物中元素的质量分数的计算,关键是根据各成分的化学式得出C、H的固定组成,学生应学会利用定组成的方法来解答混合物中元素的质量分数计算.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列说法不正确的是( )
| A、常温下,向醋酸钠溶液中滴加盐酸至溶液呈中性一定有:c(CH3COOH)=c(Cl-) | ||
| B、某酸式盐NaHA溶液中一定有:c(OH-)+c(A2-)=c(H+)+c(H2A) | ||
| C、NaHSO4溶液中滴加Ba(OH)2至溶液恰好呈中性c(Na+)>c(SO42-)>c(OH-)=c(H+) | ||
D、0.5mol/L 的Na2S溶液中:
|
下列物质中属于纯净物的是( )
| A、孔雀石 | B、铝土矿 |
| C、明矾 | D、漂白粉 |
某物质化学式为NH5,常温下是固态,能与水剧烈反应放出两种气体.在NH5中的各原子均具有稀有气体的稳定结构,则下列对NH5的描述中正确的是( )
| A、NH5与水的反应是氧化还原反应 |
| B、NH5由分子构成 |
| C、NH5属于离子化合物 |
| D、NH5中N的化合价为-5价 |
下列有关热化学方程式的叙述不正确的是( )
| A、已知2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ?mol-1,则氢气的燃烧热为285.8 kJ?mol-1 | |||
| B、已知C(石墨,s)═C(金刚石,s)△H>0,则石墨比金刚石稳定 | |||
| C、500℃、30MPa下,将0.5mol N2和足量H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)
| |||
| D、已知2C(s)+2O2(g)═2CO2(g)△H1 2C(s)+O2(g)═2CO(g)△H2,则△H1<△H2 |
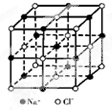 如图是NaCl晶体的一个晶胞结构模型.KO2的晶体结构与NaCl相似,KO2可以看作是
如图是NaCl晶体的一个晶胞结构模型.KO2的晶体结构与NaCl相似,KO2可以看作是Na+的位置用K+代替,Cl-位置用O2-代替,则关于KO2晶体结构的描述不正确的是( )
| A、与K+距离相等且最近的K+有12个 |
| B、与K+距离相等且最近的O2-构成的多面体是正八面体 |
| C、与K+距离相等且最近的O2-共有8个 |
| D、一个KO2晶胞中摊得的K+和O2-粒子数均为4个 |
在烧杯中加一些水,滴入几滴酚酞溶液,然后把一块钠放入水中,从这个实验过程观察到的反应现象中,不可能得出的结论是( )
| A、钠比较柔软 |
| B、钠与水反应生成碱 |
| C、钠与水反应放热 |
| D、钠与水反应放出气体 |

 太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.
太阳能电池是通过光电效应或者光化学效应直接把光能转化成电能的装置.其材料除单晶硅,还有铜铟镓硒等化合物.