题目内容
下列有关热化学方程式的叙述不正确的是( )
| A、已知2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ?mol-1,则氢气的燃烧热为285.8 kJ?mol-1 | |||
| B、已知C(石墨,s)═C(金刚石,s)△H>0,则石墨比金刚石稳定 | |||
| C、500℃、30MPa下,将0.5mol N2和足量H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为: N2(g)+3H2(g)
| |||
| D、已知2C(s)+2O2(g)═2CO2(g)△H1 2C(s)+O2(g)═2CO(g)△H2,则△H1<△H2 |
考点:反应热和焓变
专题:化学反应中的能量变化
分析:A、从燃烧热的定义来判断.
B、通过热化学方程式可知石墨和金刚石的能量高低,从而比较出稳定性.
C、注意合成氨的反应为可逆反应.
D、比较反应热△H的大小时,要带着正负号比较.
B、通过热化学方程式可知石墨和金刚石的能量高低,从而比较出稳定性.
C、注意合成氨的反应为可逆反应.
D、比较反应热△H的大小时,要带着正负号比较.
解答:
解:A、燃烧热指的是在25摄氏度,101 kPa时,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量.定义要点:①可燃物为1mol.②完全燃烧生成稳定的氧化物,即反应物中C→CO2,H2→H2O(液),S→SO2(气)等,故A正确;
B、由C(石墨,s)═C(金刚石,s)△H>0,可知反应吸热,即石墨的能量低于金刚石,而能量越低物质越稳定,故石墨比金刚石稳定,故B正确;
C、工业上合成氨的反应N2(g)+3H2(g)
2NH3(g)是可逆反应,故将0.5mol N2和足量H2置于密闭的容器中充分反应生成的NH3,放热19.3kJ时,此时生成NH3的物质的量小于1mol,故N2(g)+3H2(g)
2NH3(g)的反应热△H应小于-38.6kJ?mol-1,故C错误;
D、反应2C(s)+2O2(g)═2CO2(g)△H1 ①和反应 2C(s)+O2(g)═2CO(g)△H2 ②均为放热反应,△H均小于0.
由于反应①是碳的完全燃烧,②是碳的不完全燃烧,故①放出的热量多于②,则△H1<△H2.故D正确.
故选:C.
B、由C(石墨,s)═C(金刚石,s)△H>0,可知反应吸热,即石墨的能量低于金刚石,而能量越低物质越稳定,故石墨比金刚石稳定,故B正确;
C、工业上合成氨的反应N2(g)+3H2(g)
| 催化剂 |
| 500℃,30MPa |
| 催化剂 |
| 500℃,30MPa |
D、反应2C(s)+2O2(g)═2CO2(g)△H1 ①和反应 2C(s)+O2(g)═2CO(g)△H2 ②均为放热反应,△H均小于0.
由于反应①是碳的完全燃烧,②是碳的不完全燃烧,故①放出的热量多于②,则△H1<△H2.故D正确.
故选:C.
点评:本题从燃烧热、可逆反应等角度考查了热化学方程式的书写,综合性较强,难度适中.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列电离方程式中正确的是( )
| A、Na2HPO4溶于水:Na2HPO4=2Na++H++PO43- |
| B、NaHSO4熔化:NaHSO4=Na++H++SO42- |
| C、HF溶于少量水中:2HF=H++HF2- |
| D、(NH4)2 SO4溶于水:(NH4)2 SO4=2 NH4++SO42一 |
下列各组物质中,仅用水及物质间相互反应不能一一区别的一组是( )
| A、Na2O2 Al2(SO4)3 MgCl2 K2CO3 |
| B、BaCl2 Na2SO4 (NH4)SO4 KOH |
| C、AgNO3 NaCl KCl CuCl2 |
| D、Fe2(SO4)3 K2CO3 KHSO4 NH4Cl |
已知酸性强弱顺序为  ,下列化学方程式正确的是( )
,下列化学方程式正确的是( )
 ,下列化学方程式正确的是( )
,下列化学方程式正确的是( )A、 |
B、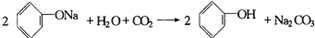 |
C、 |
D、 |
在pH相同的氢氧化钾和氨水两种溶液中( )
| A、H+的物质的量浓度相同 |
| B、溶质的物质的量浓度相同 |
| C、OH-的物质的量相同 |
| D、最多可中和硫酸的物质的量相同 |
已知在甲醛、乙酸、乙酸乙酯组成的混合物中,氧元素的质量分数为58%,则氢元素的质量分数为( )
| A、6% | B、12% |
| C、14% | D、36% |
下列实验操作中一定会造成误差的是( )
| A、将pH试纸用蒸馏水湿润后测某溶液的pH |
| B、在中和热的测定实验中用Ba(OH)2代替NaOH;H2SO4代替HCl |
| C、用碱石灰来干燥氨气 |
| D、使用托盘天平称量时将药品放在天平的右盘与砝码放在天平的左盘 |
元素X的最高正价和负价的绝对值之差为6,元素Y原子次外层与元素X原子次外层均为8个电子,X、Y的离子具有相同的电子排布,X、Y形成的化合物是( )
| A、MgF2 |
| B、MgCl2 |
| C、CaCl2 |
| D、CaBr2 |