题目内容
下列说法不正确的是( )
| A、常温下,向醋酸钠溶液中滴加盐酸至溶液呈中性一定有:c(CH3COOH)=c(Cl-) | ||
| B、某酸式盐NaHA溶液中一定有:c(OH-)+c(A2-)=c(H+)+c(H2A) | ||
| C、NaHSO4溶液中滴加Ba(OH)2至溶液恰好呈中性c(Na+)>c(SO42-)>c(OH-)=c(H+) | ||
D、0.5mol/L 的Na2S溶液中:
|
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.常温下溶液呈中性,则c(OH-)=c(H+),再结合电荷守恒、物料守恒判断;
B.H2A不一定是弱酸;
C.溶液呈中性,则存在c(OH-)=c(H+),二者反应生成硫酸钠、硫酸钡和水,所以溶液中的溶质是硫酸钠,根据电荷守恒判断;
D.溶液中存在物料守恒,根据物料守恒判断.
B.H2A不一定是弱酸;
C.溶液呈中性,则存在c(OH-)=c(H+),二者反应生成硫酸钠、硫酸钡和水,所以溶液中的溶质是硫酸钠,根据电荷守恒判断;
D.溶液中存在物料守恒,根据物料守恒判断.
解答:
解:A.常温下溶液呈中性,则c(OH-)=c(H+),根据电荷守恒得c(Na+)=c(Cl-)+c(CH3COO-),根据物料守恒得c(CH3COOH)+c(CH3COO-)=c(Na+),所以得c(CH3COOH)=c(Cl-),故A正确;
B.H2A不一定是弱酸,可能是强酸,如硫酸,如果是NaHA是强酸酸式盐,则溶液中不存在硫酸分子,故B错误;
C.溶液呈中性,则存在c(OH-)=c(H+),二者反应生成硫酸钠、硫酸钡和水,所以溶液中的溶质是硫酸钠,根据电荷守恒c(Na+)>c(SO42-),水的电离较微弱,所以溶液中存在c(Na+)>c(SO42-)>c(OH-)=c(H+),故C正确;
D.溶液中存在物料守恒,根据物料守恒得
c(Na+)=c(H2S)+c(HS-)+c(S2-)=0.5mol/L,故D正确;
故选B.
B.H2A不一定是弱酸,可能是强酸,如硫酸,如果是NaHA是强酸酸式盐,则溶液中不存在硫酸分子,故B错误;
C.溶液呈中性,则存在c(OH-)=c(H+),二者反应生成硫酸钠、硫酸钡和水,所以溶液中的溶质是硫酸钠,根据电荷守恒c(Na+)>c(SO42-),水的电离较微弱,所以溶液中存在c(Na+)>c(SO42-)>c(OH-)=c(H+),故C正确;
D.溶液中存在物料守恒,根据物料守恒得
| 1 |
| 2 |
故选B.
点评:本题考查了离子浓度大小比较,根据溶液中的溶质及其性质确定溶液酸碱性,再结合守恒思想分析解答,易错选项是B,很多同学认为该酸是弱酸而导致错误,为易错点.

练习册系列答案
相关题目
关于钠及其化合物性质的叙述,正确的是( )
| A、相同条件下,在水中碳酸钠的溶解度小于碳酸氢钠的溶解度 |
| B、氧化钠和过氧化钠都能与二氧化碳反应,生成物完全相同 |
| C、碳酸钠固体中混有少量碳酸氢钠,可用加热的方法除去 |
| D、质量相等的碳酸钠和碳酸氢钠分别与足量盐酸反应,后者产生气体少 |
仅用一种试剂就可以将苯、苯酚、CCl4、己烯等4种无色液体进行鉴别,这种试剂是( )
| A、银氨溶液 | B、新制氢氧化铜 |
| C、溴水 | D、氢氧化钠溶液 |
已知:①C(金刚石,s)+O2(g)=CO2(g);△H=-395.4kJ/mol
②C(石墨,s)+O2(g)=CO2(g);△H=-393.5kJ/mol,下列说法中正确的是( )
②C(石墨,s)+O2(g)=CO2(g);△H=-393.5kJ/mol,下列说法中正确的是( )
| A、金刚石转化为石墨为放热过程 |
| B、石墨转化为金刚石为自发过程 |
| C、石墨比金刚石能量高 |
| D、金刚石比石墨稳定 |
下列电离方程式中正确的是( )
| A、Na2HPO4溶于水:Na2HPO4=2Na++H++PO43- |
| B、NaHSO4熔化:NaHSO4=Na++H++SO42- |
| C、HF溶于少量水中:2HF=H++HF2- |
| D、(NH4)2 SO4溶于水:(NH4)2 SO4=2 NH4++SO42一 |
下列有关能量转化的说法正确的是( )
| A、煤燃烧是化学能转化为热能的过程 |
| B、动物体内葡萄糖被氧化为CO2是热能转变成化学能的过程 |
| C、化石燃料和植物燃料燃烧时放出的能量均来源于太阳能 |
| D、植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程 |
下列有机物中,含有两种官能团的是( )
| A、CH3-CH2-Cl |
B、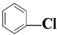 |
| C、CH2=CHBr |
D、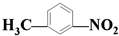 |
 美国IBM公司设计出了一款新型锂空气电池,其原理就是通过吸入空气与设备内的锂离子发生反应,进行能量的提供.因其独特的放电方式,也称呼吸式电池.负极采用金属锂条,负极的电解液采用含有锂盐的有机电解液.中间设有用于隔开正极和负极的锂离子固体电解质.正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合.如图所示.下列说法不正确的是( )
美国IBM公司设计出了一款新型锂空气电池,其原理就是通过吸入空气与设备内的锂离子发生反应,进行能量的提供.因其独特的放电方式,也称呼吸式电池.负极采用金属锂条,负极的电解液采用含有锂盐的有机电解液.中间设有用于隔开正极和负极的锂离子固体电解质.正极的水性电解液使用碱性水溶性凝胶,与由微细化碳和廉价氧化物催化剂形成的正极组合.如图所示.下列说法不正确的是( )| A、负极反应:Li-e-=Li+,金属锂以锂离子(Li+)的形式溶于有机电解液,电子供应给导线.溶解的锂离子(Li+)穿过固体电解质移到正极的水性电解液中 |
| B、正极反应:O2+2H2O+4e-=4OH-,在正极的水性电解液中与锂离子(Li+)结合生成水溶性氢氧化锂(LiOH),并能实现锂元素的循环 |
| C、在负极的有机电解液和空气极的水性电解液之间,用只能通过锂离子的固体电解质隔开,以防止两电解液发生混合,而且能促进电池发生反应 |
| D、锂-空气电池至今都未普及,原因是它存在致命缺陷,即固体反应生成物氧化锂(Li2O)在正极堆积,使电解液与空气的接触被阻断,从而导致放电停止 |
已知在甲醛、乙酸、乙酸乙酯组成的混合物中,氧元素的质量分数为58%,则氢元素的质量分数为( )
| A、6% | B、12% |
| C、14% | D、36% |