题目内容
下图甲是CO2电催化还原为碳氢化合物的工作原理示意图,用一种钾盐水溶液作电解液;图乙是用H2还原CO2制备甲醇的工作原理示意图,硫酸为电解质溶液。下列说法不正确的是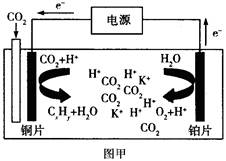
| A.甲中铜片作阴极,K+向铜片电极移动 |
| B.乙中正极发生的电极反应为CO2+6e-+6H+=CH3OH+H2O |
| C.甲中若CxHy为C2H4,则生成1 mol C2H4的同时生成2 molO2 |
| D.乙中H2SO4的作用是增强溶液的导电性 |
C
解析试题分析:A、根据装置图可知,铜片是电子流入的,因此该电极是阴极,溶液中的阳离子向负极移动,A正确;B、乙图中氢气在负极通入,CO2在正极通入,由于存在质子交换膜,因此正极电极反应式为CO2+6e-+6H+=CH3OH+H2O,B正确;C、二氧化碳中碳元素是+4价,甲中若CxHy为C2H4,则生成1 mol C2H4,转移电子的物质的量是2×[4-(-2)]=12mol,所以根据电子得失守恒可知,同时生成3molO2,C不正确;D、硫酸是强酸,完全电离,因此乙中H2SO4的作用是增强溶液的导电性,D正确,答案选C。
考点:考查电化学原理的应用

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
| A.a电极是负极 |
| B.b电极的电极反应为:4OH--4e-==2H2O+O2↑ |
| C.氢氧燃料电池是一种具有应用前景的绿色电源 |
| D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储存电池内的新型发电装置 |
用Zn片、Cu片和稀硫酸组成的电池装置。下列有关该装置的说法不正确的是( )
| A.该装置将化学能转变为电能 | B.溶液中的阳离子向锌电极移动 |
| C.Cu极上有气泡产生,发生还原反应 | D.电流方向是从铜片流向锌片 |
结合如图装置判断,下列叙述正确的是
A.若X为NaCI,K与M相连时,石墨电极反应为 |
| B.若X为硫酸,K与M相连时,Fe作负极受到保护 |
| C.若X为硫酸,K与N相连时,溶液中H+向Fe电极移动 |
| D.若X为NaCI,K与N相连时,溶液中加入少量K3[Fe(CN)6],有蓝色沉淀生成 |
固体电解质是通过离子迁移传递电荷。如RbAg4I5晶体,其中迁移的物种全是Ag+,利用RbAg4I5晶体,可以制成电化学气敏传感器,下图是一种测定O2含量的气体传感器示意图。被分析的O2可以透过聚四氟乙烯薄膜,由电池电动势变化可以得知O2的含量。在气体传感器工作过程中,下列变化肯定没有发生的是( )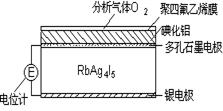
| A.Ag-e-=Ag+ | B.I2+2Ag++2e-=2AgI |
| C.I2+2Rb++2e-=2RbI | D.4AlI3+3O2=2Al2O3+6I2 |
如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2=Fe+2Li2S。下列说法正确的是
| A.该装置将电能转化为化学能 |
| B.Li+向a极移动 |
| C.可以用水代替SO(CH3)2做溶剂 |
| D.b极反应式是FeS2+4Li++4e-=Fe+2Li2S |
用酸性氢氧燃料电池为电源进行电解的实验装置如下图所示。下列说法正确的是( ) 
| A.a为负极,b为正极 |
| B.若a极是铁,b极是铜,b极逐渐溶解,a极上有铜析出 |
| C.若a、b极都是石墨,在相同条件下,理论上a极产生的气体与电池中消耗的O2体积相等 |
| D.若电解精炼粗铜时,b极是粗铜,a极是纯铜 |
某课外活动小组,为研究金属的腐蚀和防护的原理,做了以下实验:将剪下的一块镀锌铁片,放入锥形瓶中,并滴入少量食盐水将其浸湿,再加数滴酚酞试液,按如图所示的装置进行实验,过一段时间后观察,下列现象不可能出现的是( )
| A.B中导气管中产生气泡 | B.B中导气管里形成一段水柱 |
| C.金属片剪口变红 | D.锌被腐蚀 |
某原电池总反应为2Fe3++Fe=3Fe2+,不能实现该反应的原电池是( )
| A.正极为Cu,负极为Fe,电解质溶液为FeCl3 |
| B.正极为C,负极为Fe,电解质溶液为Fe(NO)3 |
| C.正极为Fe,负极为Zn,电解质溶液为Fe2(SO4)3 |
| D.正极为Ag,负极为Fe,电解质溶液为Fe2(SO4)3 |